题目内容
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
①
CaSO4(s)+CO(g)?CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?
C(s)+
CO2(g)△H3=-86.2kJ?mol-1
(1)反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H= (用△H1、△H2和△H3表示)
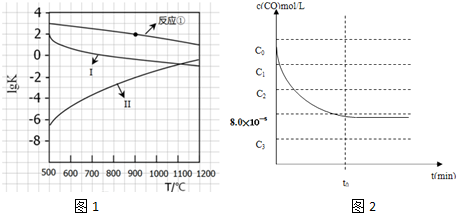
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图1,结合各反应的△H,回答下列问题.a)曲线中对应反应②的是 (选填“Ⅰ”或“Ⅱ”).
归纳lgK-T曲线变化规律:(b) .(c) .
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol?L-1 的CO,反应①于900℃达到平衡,此时c平衡(CO)=8.0×10-5 mol?L-1.
①用图1中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字).
②c(CO)随反应时间t的变化曲线如图2所示.
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应).

①
| 1 |
| 4 |
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?
| 1 |
| 2 |
| 1 |
| 2 |
(1)反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图1,结合各反应的△H,回答下列问题.a)曲线中对应反应②的是
归纳lgK-T曲线变化规律:(b)
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol?L-1 的CO,反应①于900℃达到平衡,此时c平衡(CO)=8.0×10-5 mol?L-1.
①用图1中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字).
②c(CO)随反应时间t的变化曲线如图2所示.
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应).
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)根据盖斯定律及题干中热化学方程式计算出反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H;
(2)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律;
(3)根据图象判断900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为c,根据平衡常数表达式列式计算,然后画图即可.
(2)根据反应①-③的平衡常数的对数lgK随反应温度T的变化曲线进行判断变化规律;
(3)根据图象判断900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为c,根据平衡常数表达式列式计算,然后画图即可.
解答:
解:(1)根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=4△H1+△H2+2△H3,
故答案为:4△H1+△H2+2△H3;
(2)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,故答案为:(a)Ⅱ;(b)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;(c)当温度同等变化时,△H的数值越大lgK的变化越大;
(3)
CaSO4(s)+CO(g)?
CaS(s)+CO2(g)
初始浓度(mol/L) C0 0
转化浓度(mol/L) C0-8.0×10-5 C0-8.0×10-5
平衡浓度(mol/L) 8.0×10-5 C0-8.0×10-5
K=
=
=100,解得:C0=8.08×10-5,所以α(CO)=99%,图象如下:
 ,故答案为:99%;
,故答案为:99%; .
.
故答案为:4△H1+△H2+2△H3;
(2)根据图象曲线变化可知,反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,故答案为:(a)Ⅱ;(b)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;(c)当温度同等变化时,△H的数值越大lgK的变化越大;
(3)
| 1 |
| 4 |
| 1 |
| 4 |
初始浓度(mol/L) C0 0
转化浓度(mol/L) C0-8.0×10-5 C0-8.0×10-5
平衡浓度(mol/L) 8.0×10-5 C0-8.0×10-5
K=
| c(CO2) |
| c(CO) |
| c0-8.0×10-5 |
| 8.0×10-5 |
 ,故答案为:99%;
,故答案为:99%; .
.
点评:本题考查了化学平衡常数的计算、有机物结构与性质、热化学方程式的书写等知识,题目难度中等,试题题量较大,注意掌握化学平衡常数的概念及计算方法,明确热化学方程式的书写方法及盖斯定律的含义及应用.

练习册系列答案
相关题目
 美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设.下面就是一种化学“云”-茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )
美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设.下面就是一种化学“云”-茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )| A、该有机物能使酸性高锰酸钾溶液褪色 |
| B、1mol该有机物最多可以和3molH2发生加成反应 |
| C、该有机物可以发生银镜反应 |
| D、该物质在酸性条件下的水解比在碱性条件下的水解程度大 |
能正确表示下列反应的离子方程式是( )
| A、铝与氢氧化钠溶液反应:2Al+2 OH-=2AlO2-+3H2O |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| C、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
| D、过氧化钠溶于盐酸:Na2O2+2H+=2Na++2H2O |
下列离子方程式正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、等体积、等物质的量浓度的NaHCO3和 Ba(OH)2两溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| D、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
用简便、经济的方法鉴别硫酸铜、碳酸钠、氢氧化镁三种白色固体粉末,应选用的试剂是( )
| A、紫色石蕊试液 | B、氢氧化钠溶液 |
| C、稀盐酸 | D、水 |
食品标签上常常可以看到一些食品添加剂的名称,以下食品添加剂中会对人体健康产生副作用,必须严格控制用量的是( )
| A、亚硝酸钠(发色剂) |
| B、山梨酸(防腐剂) |
| C、苯甲酸(防腐剂) |
| D、维生素(营养强化剂) |
用RU 图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,有同学通过实验得出的结论是m(H):m(O)>1:8,下列对导致这一结果原因的分析中,一定不合理的是( )

| A、Ⅰ、Ⅱ装置之间缺少干燥装置 |
| B、Ⅱ装置中的CuO粉末可能不干燥 |
| C、CuO没有全部被还原 |
| D、Ⅲ装置后缺少干燥装置 |
当不慎有大量Cl2逸出污染周围空气时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该物质适宜采用的是( )
| A、NaOH |
| B、NaCl |
| C、Ca(OH)2 |
| D、Na2CO3 |
