题目内容
6.下列有关阿伏加德罗常数(NA)的说法不正确的是( )| A. | 12 g12C所含有的碳原子数为NA个 | |
| B. | NA的近似值为6.02×1023 | |
| C. | 2 mol H2O含有的H2O分子数目为2NA个 | |
| D. | 2NA个Cl2的质量为71 g |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答;
B.NA有单位;
C.依据N=nNA计算解答;
D.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答.
解答 解:A.12 g12C所含有的碳原子数为$\frac{12g}{12g/mol}$×NA=NA个,故A正确;
B.NA的近似值为6.02×1023mol-1,故B错误;
C.2 mol H2O含有的H2O分子数目为2mol×NA=2NA个,故C正确;
D.2NA个Cl2的质量为$\frac{2{N}_{A}}{{N}_{A}}$×71g/mol=71 g,故D正确;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
17.下列叙述正确的是( )
| A. | NaCl固体可导电 | |
| B. | NaHSO4溶于水电离出H+,则NaHSO4属于酸 | |
| C. | HCl溶于水能导电,但液态HCl不能导电 | |
| D. | 导电能力强的溶液里能够自由移动的离子数目一定比导电能力弱的溶液里能够自由移动的离子数目多 |
14.下列说正确的是( )
| A. | 有单质参加的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 某种物质中只含有一种元素一定是纯净物 | |
| D. | 酸和盐一定能发生复分解反应 |
1.已知:碳的燃烧热△H1=a kJ•mol-1;
S(s)+2K(s)=K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s);△H3=c kJ•mol-1
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1. 则x为( )
S(s)+2K(s)=K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)=2KNO3(s);△H3=c kJ•mol-1
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1. 则x为( )
| A. | 3a+b-c | B. | c+3a-b | C. | a+b-c | D. | c+a-b |
18.25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
| A. | pH=4的0.1mol/L NaHA溶液:c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A) | |
| B. | 10mL 0.1mol/L CH3COOH溶液与20mL 0.1mol/L NaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| C. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1<10c2 | |
| D. | 已知:HA为弱酸,则两种溶液①0.1mol/LHA溶液;②0.3mol/LHA溶液与0.1mol/LNaOH溶液等体积的混合液,c(H+)①>② |
15.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氢气还原氧化铜 | |
| B. | 二氧化碳与氢氧化钠溶液作用生成碳酸氢钠 | |
| C. | 硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸 | |
| D. | 氯酸钾分解制氧气 |
16. X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的氢化物的沸点比W的氢化物的沸点低 | |
| C. | Y与Z 形成的化合物都可以和盐酸反应 | |
| D. | Z与Q形成的化合物的水解液一定显酸性 |
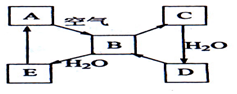 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C含有的元素种类相同,且相对分子质量之比为4:5,化合物D是重要的工业原料.