题目内容
13.氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下合成氨的途径:2NH3(g)?N2(g)+3H2(g)△H=+92.4kJ•mol-1,在恒容密闭容器中达到平衡的标志有:①.①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变.
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成3n mol H2等效于消耗2n mol NH3,同时生成2n mol NH3,正逆反应速率相等达平衡状态,故正确;
②只要反应发生,就符合用NH3、N2、H2表示反应速率比为2:1:3,故错误;
③体积一定,混合气体的密度始终不变,故错误;
故答案为:①.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
4.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.1 mol/(L•min) | B. | v(NH3)=0.2 mol/(L•min) | ||
| C. | v(H2)=0.3 mol/(L•min) | D. | v(H2)=0.4 mol/(L•min) |
1.下列有关胶体的说法不正确的是( )
| A. | 胶体带电荷,溶液不带电荷 | |
| B. | 胶体区别于其它分散系的本质特征是分散质的直径大小 | |
| C. | 将一柬光线通过胶体时可出现一条光亮的通路,通过溶液则没有此现象 | |
| D. | 土壤胶粒的表面巨大且带负电,能吸附NH${\;}_{4}^{+}$等营养离子,使土壤具有保肥能力 |
8.某白色粉末由两种物质组成,为鉴别其组成进行如下实验:①取少量样品加入适量蒸馏水得到澄清溶液;②向①所得的溶液中逐滴加入适量稀硫酸后出现浑浊.该白色粉末不可能是( )
| A. | Al2(SO4)3、NaOH | B. | Al2(NH3)2OH、KOH | C. | BaCl2、NaHCO3 | D. | Ca(ClO)2、NaHSO3 |
8.下列指定反应的离子方程式正确的是( )
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 解饱和NaCl饱和溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
6.下列有关阿伏加德罗常数(NA)的说法不正确的是( )
| A. | 12 g12C所含有的碳原子数为NA个 | |
| B. | NA的近似值为6.02×1023 | |
| C. | 2 mol H2O含有的H2O分子数目为2NA个 | |
| D. | 2NA个Cl2的质量为71 g |

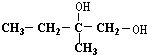 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2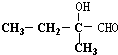 +2H2O.
+2H2O. $→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.
$→_{△}^{浓H_{2}SO_{4}}$CH3CH=C(CH3)COOH+H2O.