题目内容
20.完成以下氧化还原反应的离子反应方程式:2CrI3+27Cl2+64KOH→2K2CrO4+6KIO4+54KCl+32H2O.
分析 反应中,化合价升高的是Cr,从+3价升高到+6价,I的化合价从-1价升高到了+7价,Cl的化合价从0价降低为-1价,化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平方称式.
解答 解:反应中,化合价升高的是Cr,从+3价升高到+6价,I的化合价从-1价升高到了+7价,Cl的化合价从0价降低为-1价,化合价升高值=化合价降低值=转移电子数=54,根据电子守恒,配平方程式为:2CrI3+27Cl2+64KOH=2K2CrO4+6KIO4+54KCl+32H2O,
故答案为:2;27;64KOH;2;6;54;32.
点评 本题考查学生氧化还原反应中电子守恒的配平知识,注意知识的归纳和梳理、迁移应用是关键,难度不大.

练习册系列答案
相关题目
10.下列实验或实验过程符合“绿色化学”原则的是( )
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
8.某学习小组研究“不同条件对化学反应速率影响的研究”,选用4mL0.01mol•L-1KMnO4溶液与2mL0.1mol•L-1H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
| 组别 | 草酸的体积/mL | 温度/℃ | 其它物质 |
| ① | 2mL | 20 | |
| ② | 2mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
15.已知某化学键的键能数据如下
则CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-184kJ•mol-1.
| 化学键 | C=O | C-O | C-H | H-H | O-H |
| 键能/kJ•mol-1 | 745 | 351 | 415 | 436 | 462 |
5.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
12.取A、B、C三份不同质量的同一镁铝合金的粉末,分别与30mL相同浓度的稀盐酸在三个烧杯中充分反应,反应的有关数据如下表(气体体积均已换算为标准状况下):
上述反应中,如在再向C烧杯中加入1mol•L-1的氢氧化钠溶液若干毫升,恰能使合金中的铝溶解却不能含铝的沉淀,并使Mg2+刚好沉淀完全;过滤,得溶液,下列叙述不正确的是( )
| A | B | C | |
| 起始时合金粉末的质量/mg | 204 | 399 | 561 |
| 反应结束时生成气体的体积/mL | 224 | 336 | 336 |
| A. | 起始时盐酸的浓度为1mol•L-1 | B. | 加入的NaOH溶液为40mL | ||
| C. | 合金中镁、铝的物质的量相等 | D. | 所得的滤液中含三种阴离子 |
11.2SO2+O2$?_{△}^{催化剂}$2SO3是工业制硫酸的一步重要反应,下列关于该反应的说法正确的是( )
| A. | 使用催化剂不影响反应速率 | B. | 升高体系温度能加快反应速率 | ||
| C. | 减小SO2的浓度能加快反应速率 | D. | 反应中SO2能100%转化为SO3 |
 .水合氢离子的结构式:
.水合氢离子的结构式: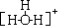 .
.