题目内容
15.已知某化学键的键能数据如下| 化学键 | C=O | C-O | C-H | H-H | O-H |
| 键能/kJ•mol-1 | 745 | 351 | 415 | 436 | 462 |
分析 反应热=反应物总键能-生成物总键能,据此计算.
解答 解:反应热=反应物总键能-生成物总键能,则:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的△H=2×745kJ/mol+3×436kJ/mol-2×462kJ/mol-3×415kJ/mol-351kJ/mol-462kJ/mol=-184kJ/mol,
故答案为:-184.
点评 本题考查反应热有关计算,难度不大,关键是明确“反应热=反应物总键能-生成物总键能”,有利于基础知识的巩固.

练习册系列答案
相关题目
5. A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
(1)A元素是H;(填元素符号).E所在周期中电负性最大的元素的基态原子价层电子排布图为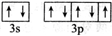 ;
;
(2)B,C,D三种元素的基态原子第一电离能由小到大的顺序为C<O<N;(用元素符号表示)
(3)向F2+的硫酸盐溶液中滴加过量氨水,观察到的现象是首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,其溶质的化学式为〔F(NH3)4]SO4,该物质的阳离子中的化学键有配位键和共价键(填“离子键”“共价键”“‘配位键”或“π键”);阴离子的空间构型为正四面体;
(4)B2A4分子中σ键与π键的个数比为5:1;
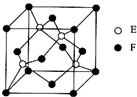
(5)E与F形成化合物晶体的晶胞如图所示.已知该晶胞的边长为a cm,则该晶体的化学式为CuS,密度为$\frac{384}{{a}^{3}{N}_{A}}$g/cm3(NA表示阿伏加德罗常数的值).
 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
 ;
;(2)B,C,D三种元素的基态原子第一电离能由小到大的顺序为C<O<N;(用元素符号表示)
(3)向F2+的硫酸盐溶液中滴加过量氨水,观察到的现象是首先生成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,其溶质的化学式为〔F(NH3)4]SO4,该物质的阳离子中的化学键有配位键和共价键(填“离子键”“共价键”“‘配位键”或“π键”);阴离子的空间构型为正四面体;
(4)B2A4分子中σ键与π键的个数比为5:1;
(5)E与F形成化合物晶体的晶胞如图所示.已知该晶胞的边长为a cm,则该晶体的化学式为CuS,密度为$\frac{384}{{a}^{3}{N}_{A}}$g/cm3(NA表示阿伏加德罗常数的值).
3.溶液、胶体和浊液这三种分散系的本质区别是( )
| A. | 是否是大量分子或离子的集合体 | B. | 分散质微粒直径的大小不同 | ||
| C. | 是否有丁达尔效应 | D. | 是否均一、稳定、透明 |
6.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.3mol氢气中含有氢原子的数目为0.3NA | |
| B. | 标准状况下,4.48L苯中含有苯分子的数目为0.2NA | |
| C. | 0.2mol•L-1CaCl2溶液中含有氯离子的数目为0.4NA | |
| D. | 1molNa2O2与足量水反应,转移的电子数为NA |
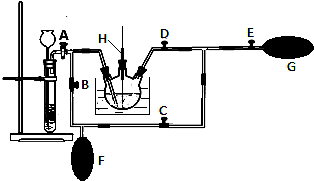
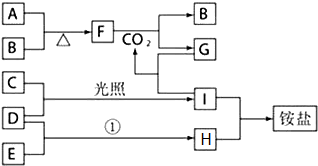 某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.
某兴趣小组的同学发现《高中化学(必修1)》中学习的单质及其化合物(或其溶液)存在如图的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;F为淡黄色粉末,化合物H和I通常状况下呈气体;反应①是化工生产中的一种重要固氮反应.