题目内容
4.下列方法可以加快铁和稀硫酸反应速率的是( )| A. | 加入少量硫酸锌 | B. | 加入少量硫酸铜 | C. | 降温 | D. | 增大压强 |
分析 影响铁与稀硫酸反应的速率的因素有浓度、温度、固体表面积以及原电池反应等,一般来说,增大浓度、升高温度、增大固体表面积或形成原电池反应,都可增大反应速率,以此解答该题.
解答 解:A.加入少量硫酸锌,铁与锌离子不反应,氢离子浓度减小,反速率减小,故A错误;
B.加入少量硫酸铜,铁置换出铜形成原电池反应,可增大反应速率,故B正确;
C.降低温度,反应速率减小,故C错误;
D.反应在溶液中进行,增大压强对反应物的浓度影响不大,故D错误;
故选B.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力的考查,注意常见影响反应速率的因素和影响原因,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
15.化学与生活、生产密切相关,下列说法正确的是( )
| A. | 煤的气化和液化都是物理变化 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM2.5是指粒径在2.5微米以下的颗粒物,其在空气中形成的分散系属于胶体 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
12.NA为阿伏加德罗常数,下列叙述正确的是 ( )
| A. | 28gCO和N2混合气体中含有原子总数为2NA | |
| B. | 在1L1mol•L-1的氨水中含有NA个NH3分子 | |
| C. | 标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA | |
| D. | 1mol Fe分别与足量Cl2、S反应,Fe失去电子数都为2NA |
19.下列有关物质的性质与应用不相对应的是( )
| A. | SO2 具有氧化性,可用于漂白纸浆 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 明矾能水解生成Al(OH)3 胶体,可用作净水剂 | |
| D. | FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路 |
9.设NA代表阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | Na2O2与H2O反应生成1.12L(标况)氧气,反应中转移电子的电子数为0.1NA | |
| C. | 1molNa与足量氧气反应,失去的电子数目为NA | |
| D. | 78gNa2O2固体中阴离子个数为2NA |
16.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒,、为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和 CO2.已知相关反应过程的能量变化如图所示,则用SO2除去CO的热化学方程式为( )

| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b-a)kJ•mol-1 | |
| B. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(b-a)kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2b-a)kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b+a)kJ•mol-1 |
14.下列实验中,所选装置不合理的是( )


| A. | 分离Na2CO3溶液和苯,选④ | B. | 用CCl4提取碘水中的碘,选③ | ||
| C. | 用FeCl2溶液吸收Cl2,选⑤ | D. | 粗盐提纯,选①和② |
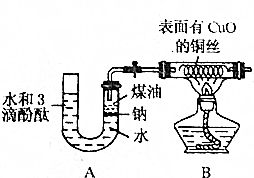 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.