题目内容
5.下列实验操作能够达到实验目的是( )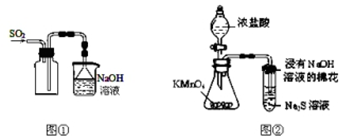
| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 | |
| C. | 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液 | |
| D. | 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
分析 A.二氧化硫的密度比空气密度大;
B.NaHCO3、Na2CO3均与Ca(OH)2溶液反应生成白色沉淀;
C.不能在容量瓶中溶解;
D.图中高锰酸钾氧化HCl生成氯气,氯气可氧化硫化钠反应生成S.
解答 解:A.二氧化硫的密度比空气密度大,则图中进气导管应伸到底部,故A错误;
B.NaHCO3、Na2CO3均与Ca(OH)2溶液反应生成白色沉淀,不能除杂,故B错误;
C.不能在容量瓶中溶解,应在烧杯中溶解,故C错误;
D.图中高锰酸钾氧化HCl生成氯气,氯气可氧化硫化钠反应生成S,则可比较KMnO4、Cl2、S的氧化性强弱,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、溶液配制、氧化性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
15.以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
16.分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
| A. | 碳酸钙、木炭 | B. | 氧化铜、硝酸钾 | C. | 乙醇、碘 | D. | 硝酸钾、氯化钠 |
13.某无色透明溶液能与铝作用放出氢气,在此溶液中一定能大量共存的离子组是( )
| A. | Al3+、Ba2+、Cl-、NO3- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | K+、Fe2+、Cl-、NO3- | D. | Na+、K+、Cl-、SO42- |
20.下列说法正确的是( )
| A. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| B. | Na2O 和Na2O2都能与水反应生成碱,它们都是碱性氧化物 | |
| C. | 铝与氢氧化钠的反应中水和氢氧化钠均作氧化剂 | |
| D. | 铝箔在空气中受热可以熔化,且发生剧烈燃烧 |
10.下列关于Na2O2的说法中,错误的一项是( )
| A. | 钠与氧气直接反应不能得到Na2O2 | |
| B. | Na2O2遇水剧烈反应放出O2,且每生成1 mol O2转移2 mol电子 | |
| C. | Na2O2与CO2可以反应放出O2,因此可以用作潜水艇的供氧剂 | |
| D. | Na2O2在空气中长时间暴露最后会生成Na2CO3 |