题目内容
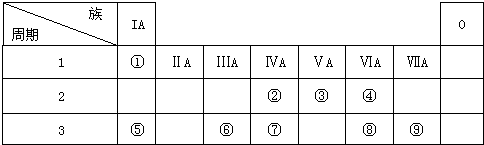
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) . a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(5)元素⑧的原子结构示意图是 .
(6)写出元素⑤形成的单质在氧气中燃烧的化学方程式 ,这一反应是 (填“吸热”或“放热”)反应.

(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
(5)元素⑧的原子结构示意图是
(6)写出元素⑤形成的单质在氧气中燃烧的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为S元素,⑨为Cl元素,
(1)周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(2)元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(3)①、④、⑤、⑨中的某些元素可形成NaOH、NaClO等离子化合物;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2;
(5)元素⑧S元素,原子核外有3个电子层,最外层电子数为6;
(6)钠在氧气中燃烧生成过氧化钠,为放热反应.
(1)周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(2)元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(3)①、④、⑤、⑨中的某些元素可形成NaOH、NaClO等离子化合物;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2;
(5)元素⑧S元素,原子核外有3个电子层,最外层电子数为6;
(6)钠在氧气中燃烧生成过氧化钠,为放热反应.
解答:
解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为S元素,⑨为Cl元素,
(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,
故答案为:HNO3>H2CO3>H2SiO3 ;
(3)①、④、⑤、⑨中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为 、
、 ,
,
故答案为: 或
或  ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)元素⑧S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为 ,
,
故答案为: ;
;
(6)钠在氧气中燃烧生成过氧化钠,为放热反应,方程式为2Na+O2
Na2O2,
故答案为:2Na+O2
Na2O2;放热.
(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径Na>Al>O,故答案为:Na>Al>O;
(2)②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,
故答案为:HNO3>H2CO3>H2SiO3 ;
(3)①、④、⑤、⑨中的某些元素可形成NaOH、NaClO等离子化合物,电子式分别为
 、
、 ,
,故答案为:
 或
或  ;
;(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)元素⑧S元素,原子核外有3个电子层,最外层电子数为6,原子结构示意图为
 ,
,故答案为:
 ;
;(6)钠在氧气中燃烧生成过氧化钠,为放热反应,方程式为2Na+O2
| ||
故答案为:2Na+O2
| ||
点评:本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )| A、重金属离子可导致蛋白质变性 |
| B、苯是最简单的芳香烃 |
| C、SO2、NxOy都属于酸性氧化物 |
| D、利用丁达尔效应可检验雾霾是否为胶体 |
下列离子方程式中正确的是( )
| A、Cl2通入水中:Cl2+H2O?2H++Cl-+C1O- | ||||
| B、钢铁发生吸氧腐蚀时,铁作负极:Fe-3e-=Fe3+ | ||||
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | ||||
D、用铜作阳极电解CuSO4溶液:2Cu2++2H2O
|
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: