题目内容
17.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )| A. | W、X只能形成一种化合物 | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 离子半径:Y>Z>X | D. | X与Y不能存在于同一离子化合物中 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为18,Y、Z最外层电子数之和是18-1-5=12,最外层电子数只能为5、7,又Y原子序数小于Z,则Y是P元素、Z是Cl元素,据此解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为18,Y、Z最外层电子数之和是18-1-5=12,最外层电子数只能为5、7,又Y原子序数小于Z,则Y是P元素、Z是Cl元素.
A.H、N元素可以形成NH3、N2H4等化合物,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P<Cl,最高价氧化物的水化物酸性H3PO4<HClO4,但氧化物的水化物的酸性不一定存在此规律,如磷酸酸性大于次氯酸,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故阴离子的半径:Y(P3-)>Z(Cl-)>X(N3-),故C正确;
D.X、Y分别是N、P元素,可以形成磷酸铵、磷酸一氢铵、磷酸二氢铵,磷酸铵、磷酸一氢铵、磷酸二氢铵都是铵盐,属于离子化合物,故D错误.
故选C.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,易错选项是B,学生容易忽略最高价含氧酸.

练习册系列答案
相关题目
7.下列溶液中的Cl-的浓度与100mL l.5mol•L-1CaCl2溶液中的Cl-的浓度相等的是( )
| A. | 150 mL 1.5 mo1•L-1NaCl溶液 | B. | 75 mL 3 mol•L-1MgCl2溶液 | ||
| C. | 150 mL 2 mo1•L-1KCl溶液 | D. | 75 mL 1 mol•L-1A1C13溶液 |
8.下列树脂在一定条件下不能制成塑料的是( )
| A. | 聚乙烯 | B. | 聚氯乙烯 | C. | 酚醛树脂 | D. | 聚四氟乙烯 |
12.浓度为0.1mol•L-1的醋酸溶液用水稀释后,下列说法错误的是( )
| A. | c(OH-)增大 | B. | H+数目增多 | C. | c(H+)增大 | D. | 导电性减弱 |
2.亚氯酸钠(NaClO2)是重要的含氯消毒剂,工业上主要有吸收法和电解法两种制取方法.生产过程中生成的ClO2气体不稳定,浓度高时易爆炸.简易工艺流程如下所示:下列说法中不正确的是( )

| A. | 空气的只要作用是提供氧气作氧化剂 | |
| B. | 电解法中ClO2在阴极发生的电极反应式为:ClO2+Na++e-=NaClO2 | |
| C. | 吸收法中加入H2O2主要是做还原剂 | |
| D. | 从环保的角度考虑,电解法比吸收法更环保 |
 CH3CHBrCH=CH2
CH3CHBrCH=CH2
 、
、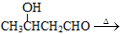 CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O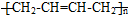 )的合成路线:___________________________。
)的合成路线:___________________________。