题目内容
12.浓度为0.1mol•L-1的醋酸溶液用水稀释后,下列说法错误的是( )| A. | c(OH-)增大 | B. | H+数目增多 | C. | c(H+)增大 | D. | 导电性减弱 |
分析 醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,根据醋酸的电离程度确定溶液中微粒个数变化.
解答 解:A.加水稀释醋酸溶液,促进醋酸电离,氢离子的物质的量增大,但是溶液体积增大程度大于氢离子物质的量增大程度,所以c(H+)减小,由于Kw不变,所以c(OH-)增大,故A正确;
B.加水稀释醋酸,促进醋酸电离,溶液中氢离子总数增多,故B正确;
C.加水稀释醋酸,虽然促进醋酸电离,但是溶液体积增大程度大于氢离子物质的量增大程度,所以c(H+)减小,故C错误;
D.加水稀释醋酸,虽然促进醋酸电离,溶液中离子个数增多,但离子浓度降低,所以导电能力减弱,故D正确;
故选C.
点评 本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释醋酸时溶液中氢离子、醋酸分子、醋酸根离子浓度都减小,但氢氧根离子浓度增大,为易错点.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
2.某烃的结构简式为CH2=C-CH=C(C2H5)-C≡C-CH3分子中处于四面体中心碳原子数为a,一定在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则abc分别为( )
| A. | 2,4,8 | B. | 3,4,8 | C. | 2,3,9 | D. | 3,4,9 |
3.下列与反应原理相关的叙述不正确的是( )
| A. | 装置Ⅰ中不可能发生如下反应:Fe+2Fe3+=3Fe2+ | |
| B. | 装置Ⅱ在反应结束时溶液中存在Fe2+ | |
| C. | 装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同 | |
| D. | 装置Ⅱ中的铁丝能发生电化学腐蚀 |
20.硒(Se)是人体健康必需的一种微量元素.已知Se的原子结构示意图为: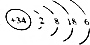 下列说法不正确的是( )
下列说法不正确的是( )
 下列说法不正确的是( )
下列说法不正确的是( )| A. | 该原子的质量数为34 | B. | 该元素处于第四周期第ⅥA族 | ||
| C. | SeO2既有氧化性又有还原性 | D. | 酸性:HClO4>H2SeO4 |
7.下列物质中含有两种官能团的是( )
| A. | 四氯甲烷(CCl4) | B. | 甘油 | C. | 乙烷(CH3CH3) | D. | 氯乙烯(CH2═CHCl) |
17.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18.下列说法正确的是( )
| A. | W、X只能形成一种化合物 | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 离子半径:Y>Z>X | D. | X与Y不能存在于同一离子化合物中 |
4.结构简式为 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
 的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )
的有机物分子1mol,与NaOH溶液混合并水浴加热,完全反应后,消耗NaOH的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |