题目内容
11.下表所示实验,现象和结论均正确的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 向浓度均为0.lmol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
| C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和SO32- |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+KSCN?Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶度积常数表达式相同且NaCl、NaI的物质的量浓度相同时,溶度积常数越小的越先产生沉淀;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,要根据钠盐溶液pH大小确定非金属性强弱时必须是其最高价含氧酸的盐;
C.S2O32-、HS-和HSO3-的混合溶液分别稀盐酸反应也生成气体和沉淀;
D.该可逆反应中实质上KCl不参加反应,所以KCl不影响平衡移动.
解答 解:A.溶度积常数表达式相同且NaCl、NaI的物质的量浓度相同时,溶度积常数越小的越先产生沉淀,该实验中先生成AgI沉淀,所以AgI溶度积常数较小,则Ksp(AgCl)>Ksp(AgI),故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,要根据钠盐溶液pH大小确定非金属性强弱时必须是其最高价含氧酸的盐,亚硫酸钠不是S元素最高价氧化物的水化物的盐溶液,所以不能根据等物质的量浓度的Na2CO3和Na2SO3溶液的pH值判断非金属的非金属性强弱,故B错误;
C.S2O32-、HS-和HSO3-的混合溶液分别稀盐酸反应也生成气体和沉淀,所以该溶液中可能含有S2O32-或HS-和HSO3-,所以该实验结论错误,故C错误;
D.该可逆反应中实质上KCl不参加反应,所以KCl不影响平衡移动,则加入KCl固体时溶液颜色不变,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生实验操作、实验分析判断能力,明确实验原理及物质性质是解本题关键,注意A中NaCl、NaI浓度必须相同且硝酸银溶液不能过量,为易错题.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
7.A、B、C、D、E为原子序数依次增大的五种短周期元素,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B,C和E形成的化合物在水中均呈碱性.下列说法正确的是( )
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
19.图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )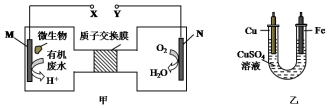

| A. | N为正极,铁电极应与Y相连接 | |
| B. | M电极反应式:CO(NH2)2+H2O-6e-═CO2↑+N2↑+6H+ | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g | |
| D. | H十透过质子交换膜由右向左移动 |
6.下列说法正确的是( )
| A. | 乙烯和乙醇均能被酸性高锰酸钾溶液氧化 | |
| B. | 甲烷和苯均可在光照的条件下与氯气发生取代反应 | |
| C. | 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应 | |
| D. | 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应 |
16.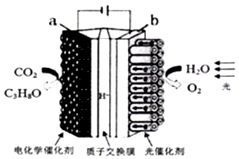 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O | |
| C. | 该装置工作时,H+从b极区向a极区迁移 | |
| D. | 每生成1molO2有44gCO2被还原 |
3.欲证明一瓶无色液体是纯水,可靠的实验方法是( )
| A. | 1.01×105Pa时沸点为100℃ | B. | 测得其pH=7 | ||
| C. | 遇钠生成氢气 | D. | 电解时得到H2与O2的体积比为2:1 |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| B. | 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA | |
| C. | 室温下,l L pH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| D. | 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA |
2.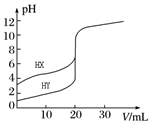 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )| A. | pH=7时,滴定HX消耗NaOH溶液体积等于20.00 mL | |
| B. | 将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH (HX) | |
| C. | 当NaOH溶液体积为20.00 mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-) |
 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.