题目内容
16.现有1950g发烟硫酸(用a SO3•H2O 表示),SO3和H2SO4的质量分数分别为0.2和0.8,加b g水稀释成某浓度的硫酸(用H2SO4•$\frac{1}{9}$H2O 表示),则以下正确的是(允许最后一位数字不同)( )| A. | a=1.38 | B. | a=1.31 | C. | b=174 | D. | b=129 |
分析 根据发烟硫酸中H2SO4和SO3的质量关系可得a的值,用H2SO4•$\frac{1}{9}$H2O表示的是质量分数是98%的硫酸,
三氧化硫和水反应得到硫酸,根据硫酸的质量分数=$\frac{三氧化硫和水反应得到硫酸的质量+原来硫酸的质量}{溶液的总质量}$×100=98%来计算加水的量.
解答 解:根据发烟硫酸中H2SO4和SO3的质量关系可得:98:80(a-1)=0.8:0.2,解得:a=1.30625≈1.31,H2SO4•$\frac{1}{9}$H2O表示质量分数是98%的硫酸,在发烟硫酸中SO3和H2SO4的质量分数分别为0.2和0.8,则三氧化硫和水反应得到硫酸的质量是$\frac{1950g×0.2}{80g/mol}$×98g/mol=477.75g,根据所加水后硫酸的质量分数是98%,则$\frac{477.75g+1950g×0.8}{1950g+b}$=98%,解得b≈129.
故选BD.
点评 本题考查了硫酸质量分数的计算题,注意公式的灵活应用是关键,计算量较大,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如图.下列说法正确的是( )


| A. | 在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) | |
| B. | 稀释前,c(ROH)=10c(MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
11.石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图.有关说法错误的是( )

| A. | 晶体中碳原子键全部是碳碳单键 | |
| B. | 石墨烯与金刚石都是碳的同素异形体 | |
| C. | 石墨烯中所有碳原子可以处于同一个平面 | |
| D. | 从石墨中剥离得到石墨烯需克服分子间作用力 |
8.将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是( )
| A. | Cu | B. | S | C. | CuS | D. | Cu2S |
6.已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法正确的是( )
| A. | 1mol氢气完全燃烧生成液态水放出的热量小于241.8KJ | |
| B. | 1mol水蒸气完全分解成氢气与氧气,需吸收241.8kJ热量 | |
| C. | 2mol氢气与1mol氧气的总能量小于2mol 水蒸气的总能量 | |
| D. | 2mol氢氢键和1mol氧氧键拆开所消耗的能量大于4mol氢氧键成键所放出的能量 |
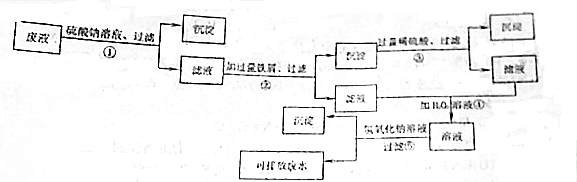
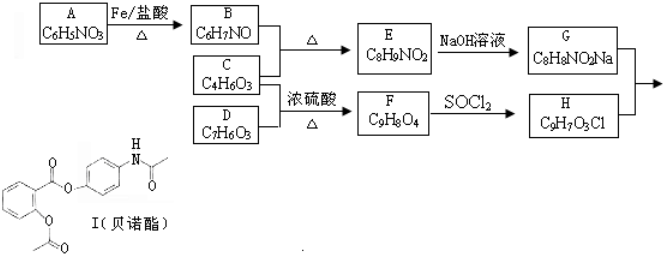
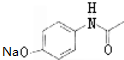 .
. (其中的三种).
(其中的三种). 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件).示例:CH4$→_{光照}^{2Cl}$CH3Cl$→_{△}^{NaOH溶液}$CH3OH.
 .
. .
.