题目内容
6.MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如图.下列说法正确的是( )
| A. | 在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) | |
| B. | 稀释前,c(ROH)=10c(MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
分析 由图象曲线变化可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,
A.x点时氢氧根离子浓度相同,则c(M+)=c(R+),且对水的电离平衡的影响相同;
B.MOH为弱电解质,在溶液中部分电离,稀释前c(MOH)>0.01mol/L;
C.ROH为强碱,pH=13的ROH的浓度为0.1mol/L,与等体积pH=1的H2SO4混合后恰好完全反应生成强酸强碱盐,溶液呈中性;
D.MOH为弱碱,二者反应后生成强酸弱碱盐MCl,M+部分水解,溶液呈酸性,则c(H+)>c(OH-)、c(M+)<c(Cl-).
解答 解:由图象曲线变化可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,
A.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则对水的电离的原子程度相同,根据电荷守恒可知:c(M+)=c(R+),故A正确;
B.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故B错误;
C.pH=13的ROH的浓度为0.1mol/L,pH=1的硫酸溶液中氢离子浓度为0.1mol/L,两溶液等体积混合后恰好发生反应生成强酸强碱盐,混合液显示中性,故C错误;
D.等体积等浓度的MOH和HCl混合后,恰好反应生成强酸弱碱盐MCl,M+部分水解,溶液呈酸性,则c(H+)>c(OH-)、c(M+)<c(Cl-),所以溶液中离子浓度大小关系为:c(Cl-)>c(M+)>c(H+)>c(OH-),故D错误;
故选A.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及判断离子浓度大小的方法.

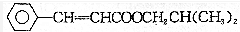 ,下列有关说法中错误的是( )
,下列有关说法中错误的是( )| A. | 在碱溶液中易变质 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为C13H16O2 | |
| D. | 与HCl恰好完全加成时可得到一种纯净物 |
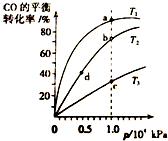 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是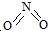 和
和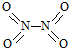 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1
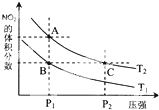
(2)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),该反应的平衡常数K的值为2.8,升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
| A. | 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶 | |
| B. | 量取浓硫酸的体积为24 mL | |
| C. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温 | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容 |
| A. | Mg | B. | Al | C. | Si | D. | S |
| A. | a=1.38 | B. | a=1.31 | C. | b=174 | D. | b=129 |
