题目内容
4.为处理含有Fe3+,Ba2+,Cu2+三种离子的废液,某学习小组设计了如下方案.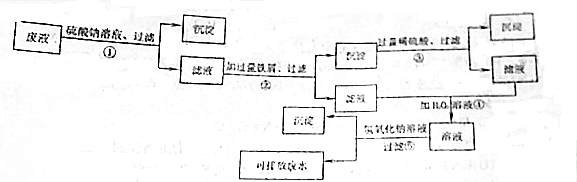
(1)在操作①②③④⑤中存在复分解反应的有①、⑤(填序号,下同),存在氧化还原反应的有②、③、④
(2)操作①中所得沉淀为BaSO4(用化学式填写),其用途之一是钡餐,操作⑤中所得沉淀的颜色为红褐色
(3)操作④所得溶液中存在的金属阳离子有Na+,Fe3+,检验它们的方法分别是焰色反应、滴加KSCN溶液.
分析 含有Fe3+,Ba2+,Cu2+三种离子的废液中滴加硫酸钠溶液,因发生Ba2++SO42-=BaSO4↓,过滤除去硫酸钡沉淀,滤液里加入过量铁粉,将溶液里的Fe3+完全转化为Fe2+,同时可将Cu2+完全还原成Cu,发生的离子反应为2Fe3++Fe=3Fe2+和Fe+Cu2+=Fe2++Cu,过滤得到的不溶物为铜和过量的铁,步骤③用过量的酸溶解铁,过滤得到的沉淀为Cu,发生的离子反应为Fe+2H+=Fe2++H2↑,步骤④是在含有Fe2+的溶液里滴加过量的H2O2溶液,氧化得到Fe3+,发生的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,步骤⑤是在含有Fe3+的溶液里滴加氢氧化钠溶液得到Fe(OH)3红褐色沉淀,发生的离子反应为Fe3++3OH-=Fe(OH)3↓,据此分析解答.
解答 解:含有Fe3+,Ba2+,Cu2+三种离子的废液中滴加硫酸钠溶液,因发生Ba2++SO42-=BaSO4↓,过滤除去硫酸钡沉淀,滤液里加入过量铁粉,将溶液里的Fe3+完全转化为Fe2+,同时可将Cu2+完全还原成Cu,发生的离子反应为2Fe3++Fe=3Fe2+和Fe+Cu2+=Fe2++Cu,过滤得到的不溶物为铜和过量的铁,步骤③用过量的酸溶解铁,过滤得到的沉淀为Cu,发生的离子反应为Fe+2H+=Fe2++H2↑,步骤④是在含有Fe2+的溶液里滴加过量的H2O2溶液,氧化得到Fe3+,发生的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,步骤⑤是在含有Fe3+的溶液里滴加氢氧化钠溶液得到Fe(OH)3红褐色沉淀,发生的离子反应为Fe3++3OH-=Fe(OH)3↓;
(1)结合上述分析可知,操作①、⑤中发生了复分解反应,操作②、③、④中存在氧化还原反应,故答案为:①、⑤;②、③、④;
(2)操作①中得到的白色沉淀为BaSO4,医药上常用作钡餐,用于胃部检查;操作⑤得到的是红褐色Fe(OH)3沉淀,故答案为:BaSO4;钡餐;红褐;
(3)操作④中得到的溶液里含有的金属阳离子有Na+和Fe3+,Na+的检验用焰色反应,Fe3+的检验滴加KSCN溶液,故答案为:Na+;Fe3+;焰色反应、滴加KSCN溶液.
点评 本题以废液处理为载体,考查离子反应、氧化还原反应及离子检验,综合性比较强,但重视的是基础性考查,难度不大,只要基础扎实,并有一定基础的分析问题的能力,定能成功解答.

 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是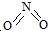 和
和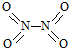 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1
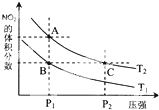
(2)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),该反应的平衡常数K的值为2.8,升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.
| 实验内容 | 实验目的 | |
| A | 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液先变红色后褪色 | 证明有氯水具有酸性 |
| B | 将Cl2通入NaBr溶液中,溶液变黄 | 比较氯气比液溴的氧化性强 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向某待测溶液中,加入BaCl2溶液,产生白色沉淀,继续滴加稀盐酸,沉淀不消失 | 证明待测溶液中含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.有关说法正确的是( )| A. | 等浓度的两种酸其酸性相同 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子相比多了两个碳碳双键 | |
| D. | 鞣酸能与Fe3+发生显色反应,而莽草酸不能 |
| A. | a=1.38 | B. | a=1.31 | C. | b=174 | D. | b=129 |
| A. | 比较钾、钠:Na、K、H2O | |
| B. | 比较镁、铝:MgCl2溶液、AlCl3溶液、NaOH溶液 | |
| C. | 比较硫、氯:Na2S溶液、NaCl溶液、pH试纸 | |
| D. | 比较溴、碘:溴水、KI淀粉试纸 |

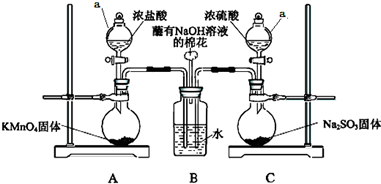 某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.
某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验.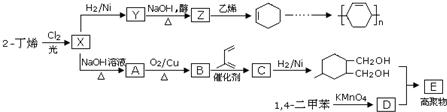
 .
. ;甲是A的一种同分异构体,其能实现转化:
;甲是A的一种同分异构体,其能实现转化: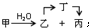 ,甲的名称为乙酸乙酯;
,甲的名称为乙酸乙酯;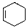 可以合成
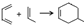
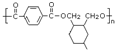
可以合成 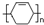 .按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.
.按合成路线的顺序,涉及反应的反应类型有:加成、消去、加聚.