题目内容
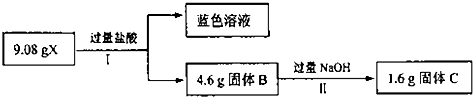
某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.进行如图实验.
请回答:
(1)Ⅰ过程中一定发生的化学反应是,用离子方程式表示 .
(2)反应Ⅱ的化学方程式是 .
(3)为进一步确定上述混合物X的成分,另取9.08gX加入足量的NaOH溶液,过滤,洗涤,干燥得固体6.08g.A中含有的物质为 .计算各组份的物质的量,写出计算过程:(已知相对原子质量:Cu:64
Al:27 Fe:56 Si:30 O:16 H:1 )

请回答:
(1)Ⅰ过程中一定发生的化学反应是,用离子方程式表示
(2)反应Ⅱ的化学方程式是
(3)为进一步确定上述混合物X的成分,另取9.08gX加入足量的NaOH溶液,过滤,洗涤,干燥得固体6.08g.A中含有的物质为
Al:27 Fe:56 Si:30 O:16 H:1 )
考点:有关混合物反应的计算
专题:
分析:9.08gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.60g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O;Cu+2Fe3+=2Fe2++Cu2+,SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.6g固体只含Cu.
(1)Fe203能与盐酸反应生成氯化铁,铜能与三价铁离子反应;
(2)二氧化硅能与氢氧化钠反应生成硅酸钠;
(3)由流程可知二氧化硅的质量为3.0g,9.08gX与过量的氢氧化钠溶液反应后得到6.08g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.08g,设Fe2O3为xmol,Cu为ymol,则160x+64y=6.08,
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y-x)mol×64g/mol=1.6g,
解方程式组得到x、y的物质的量.
(1)Fe203能与盐酸反应生成氯化铁,铜能与三价铁离子反应;
(2)二氧化硅能与氢氧化钠反应生成硅酸钠;
(3)由流程可知二氧化硅的质量为3.0g,9.08gX与过量的氢氧化钠溶液反应后得到6.08g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,二氧化硅质量为3.0g,则Fe2O3、Cu一共6.08g,设Fe2O3为xmol,Cu为ymol,则160x+64y=6.08,
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y-x)mol×64g/mol=1.6g,
解方程式组得到x、y的物质的量.
解答:
解:9.08gX和过量盐酸反应生成蓝色溶液,所以是铜离子的颜色,但是金属Cu和盐酸不反应,所以一定含有氧化铁,和盐酸反应生成的三价铁离子可以和金属铜反应,二氧化硅可以和氢氧化钠反应,4.60g固体和氢氧化钠反应后,固体质量减少了3.0g,所以该固体为二氧化硅,质量为3.0g,涉及的反应有:Fe2O3+6H+=2Fe3++3H2O;Cu+2Fe3+=2Fe2++Cu2+,SiO2+2NaOH=Na2SiO3+H2O,又Cu与NaOH不反应,1.6g固体只含Cu;9.08gX与过量的氢氧化钠溶液反应后得到6.08g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,
(1)通过以上分析可知X中一定存在的是Cu、Fe2O3、SiO2,Fe203能与盐酸反应生成氯化铁,离子方程式:Fe2O3+6H+═2Fe3++3H2O,铜能与三价铁离子反应,离子方程式:Cu+2Fe3+═2Fe2++Cu2+;
故答案为:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;
(2)二氧化硅能与氢氧化钠反应生成硅酸钠,化学方程式是SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(3)由流程可知二氧化硅的质量为3.0g,9.08gX与过量的氢氧化钠溶液反应后得到6.08g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,二氧化硅质量为3.0g,n(SiO2)=
=0.1mol,故混合物中含Fe2O3、Cu、SiO2,则Fe2O3、Cu一共6.08g,设Fe2O3为xmol,Cu为ymol,则160x+64y=6.08,
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y-x)mol×64g/mol=1.6g,
解得:x=0.02,y=0.045,
答:A中含有的物质为:Cu、Fe2O3、SiO2,
n(Fe2O3)=0.02mol,n(Cu)=0.045mol,n(SiO2)=0.1mol.
(1)通过以上分析可知X中一定存在的是Cu、Fe2O3、SiO2,Fe203能与盐酸反应生成氯化铁,离子方程式:Fe2O3+6H+═2Fe3++3H2O,铜能与三价铁离子反应,离子方程式:Cu+2Fe3+═2Fe2++Cu2+;
故答案为:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;
(2)二氧化硅能与氢氧化钠反应生成硅酸钠,化学方程式是SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(3)由流程可知二氧化硅的质量为3.0g,9.08gX与过量的氢氧化钠溶液反应后得到6.08g不溶物,固体质量减少3g,则原固体中只含有SiO2,没有Al2O3,二氧化硅质量为3.0g,n(SiO2)=
| 3g |
| 30g/mol |
Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,
xmol 2xmol xmol 2xmol
则反应剩余的Cu为:(y-x)mol×64g/mol=1.6g,
解得:x=0.02,y=0.045,
答:A中含有的物质为:Cu、Fe2O3、SiO2,
n(Fe2O3)=0.02mol,n(Cu)=0.045mol,n(SiO2)=0.1mol.
点评:本题考查混合物成分的推断及计算,注意根据反应现象判断存在的物质,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的物质的量.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
2008年是不平凡的一年,有悲痛也有激动,下列说法中有关化学的知识正确的是( )
| A、美丽的“水立方”是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色泡墙之内,钢结构的基本单位是一个由12个正五边形和2个正六边形组成的几何细胞,覆盖这个框架的是半透明的“气泡”,称为ETFE,该材料为四氟乙烯(CF2=CF2)与乙烯的共聚物,ETFE属于有机物中的烃类. |
| B、5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂,如:Ca(ClO)2、ClO2、Al(OH)3等. |
| C、美国科学家马丁?查非(Martin Chalfie)、美国华裔化学家钱永健(Roger Tsien)以及日本科学家下村修(Osamu Shimomura)因发现和研究绿色荧光蛋白(green fluorescent protein,GFP)而获2008年度诺贝尔化学奖.向GFP中加入重金属离子,GFP就会变性. |
| D、神舟七号载人飞船于2008年9月25日21点10分发射升空.中国航天员首次空间出舱活动.“神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT.其中Li的质量数为7,这三种物质的化学性质不相同. |
下列反应的离子方程式书写正确的是( )
| A、向明矾溶液中加入等物质的量的Ba(OH)2溶液Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、向Fe2(SO4)3溶液中通入足量的H2S:Fe3++H2S=Fe2++S↓+2H+ |
| C、向硝酸银溶液中滴加过量氨水:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、含等物质的量的硫酸氢铵与氢氧化钠两种溶液混合:NH4++HSO4-+2OH-=SO42-+NH3↑+2H2O |
下列实验操作与安全事故处理正确的是( )
| A、金属钠着火时可用干粉灭火器扑灭 |
| B、在硫酸铜晶体结晶水含量测定的实验中,称量操作至少需要四次 |
| C、铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体 |
| D、在250 mL烧杯中加入216 mL水和24 g NaOH固体,配制10%NaOH溶液 |
已知X、Y两元素能实现如图所示的转化: ,下列说法中错误的是( )
,下列说法中错误的是( )
 ,下列说法中错误的是( )
,下列说法中错误的是( )| A、X可以是金属 |
| B、X可以是非金属 |
| C、m可以等于1或2 |
| D、XYm与XYn的相互转化是可逆反应 |
下列反应的离子方程式书写中,正确的是( )
| A、将氨水逐滴滴加到AlCl3溶液中:Al3++3OH-=Al(OH)3↓ |
| B、铜与稀硝酸反应:Cu+4H++NO3-=Cu2++NO↑+2H2O |
| C、硫酸与氢氧化钡在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、用FeCl3溶液腐蚀铜箔制造的印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
已知卤代烃在碱性条件下易水解.某有机物的结构简式如下则下列说法正确的是( )

| A、该有机物的分子式为:C16H9O8N2Br2 |
| B、向该有机物溶液中加入FeCl3溶液,振荡后有紫色沉淀产生 |
| C、1mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗6 mol NaOH |
| D、该有机物在稀硫酸中加热水解,有机产物只有一种 |

 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.