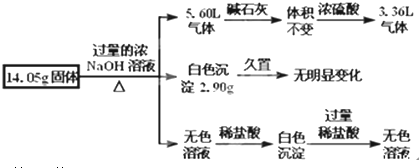
题目内容
13.下列电离方程式正确的是( )| A. | H2SO4?2H++SO42- | B. | BaCl2═Ba2++2Cl- | ||
| C. | NH3•H2O═NH4++OH- | D. | Na2CO3═Na++CO32- |
分析 强电解质完全电离用等号;弱电解质部分电离用可逆号;电离方程式遵循原子个数、电荷数守恒规律,据此解答.
解答 解:A.硫酸为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,故A错误;
B.氯化钡为强电解质,完全电离,电离方程式:BaCl2═Ba2++2Cl-,故B正确;
C.一水合铵为弱电解质,部分电离,电离方程式:NH3•H2O?NH4++OH-,故C错误;
D.碳酸钠为强电解质,完全电离,电离方程式:Na2CO3═2Na++CO32-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意电离方程式遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
3.某含Na+的溶液中可能含有Al3+、NH4+、Fe3+、CO32-、I-、SO32-.取样,滴加足量氯水,有气泡产生;继续向溶液中加BaCl2溶液或淀粉均无现象.为确定该溶液的组成,还需进行的实验有( )
| A. | 取样,滴加硫氰化钾溶液 | |
| B. | 取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,逐滴滴入氢氧化钠溶液直至足量 | |
| D. | 取样,加足量盐酸加热,湿润的品红试纸检验气体 |
1.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都是天然高分子化合物 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 铝的还原性很强,铝热反应可以冶炼Fe、V、Cr等难熔化金属 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
18.对下列物质的分类正确的是( )
| A. | 稀盐酸属于纯净物 | B. | SO2属于酸性氧化物 | ||
| C. | 纯碱属于碱 | D. | Mn2O7属于碱性氧化物 |
2.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )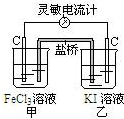

| A. | 反应开始时,乙中石墨电极上发生还原反应 | |
| B. | 反应开始时,甲中石墨电极上Fe3+被氧化 | |
| C. | 盐桥中的K+向乙中迁移,Cl-向甲中迁移 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
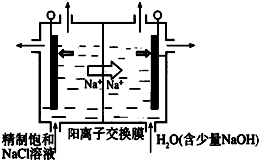 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺