题目内容
将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH溶液的浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
考点:有关混合物反应的计算
专题:计算题
分析:反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入NaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4),再根据c=
计算.
| n |
| V |
解答:
解:pH=1的硫酸,氢离子浓度为0.1mol/L,则c(H2SO4)=
×0.1mol/L=0.05mol/L;
反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.05mol/L=0.01mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol×2=0.02mol,则该c(NaOH)=
=0.2mol/L,故选B.
| 1 |
| 2 |
反应生成硫酸铝、硫酸铁,且硫酸有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.2L×0.05mol/L=0.01mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.01mol×2=0.02mol,则该c(NaOH)=
| 0.02mol |
| 0.1L |
点评:本题考查混合物的计算,明确最后溶液中的溶质是解本题关键,再结合原子守恒来分析解答,侧重考查学生分析问题及解决问题的能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、在标准状况下,1 mol水的体积是22.4 L |
| B、1 mol H2所占的体积一定是22.4 L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4 L |
| D、在标准状况下,总质量为28 g的N2和CO的混合气体,其体积约为22.4 L |
化学源于生活又用于生活,下列有关应用不正确的是( )
| A、核电站泄露的放射性物质131I和127I互为同位素,它们的化学性质相似 |
| B、纤维素、淀粉、蛋白质都是天然高分子化合物 |
| C、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| D、医药中常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性 |
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
ag铁粉与含有H2SO4的CuSO4溶液完全反应后,固体质量与反应前相同,则参加反应的CuSO4与H2SO4的物质的量之比为( )
| A、1:7 | B、7:1 |
| C、7:8 | D、8:7 |
“善待地球,科学发展,构建和谐”是“世界地球日”的主题.你认为下列行为不符的( )
| A、控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用,即:减少资源消耗、增加资源的重复使用、资源的循环利用 |
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-
3H2↑+FeO42-.下列说法正确的是( )
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、阴极发生的电极反应为6H2O+6e-═3H2↑+6OH- |
| C、阳极附近溶液pH变大 |
| D、铁失去3mol电子可以在阴极得到33.6L氢气 |
《联合国气候变化框架公约》第十七次缔约方大会暨《京都议定书》第七次缔约方会议11月28日在南非港口城市德班召开.全世界各国要采取措施减少温室气体排放,低碳生活应从我做起.以下做法不能体现低碳生活的是( )
| A、注意节约用电 |
| B、尽量搭乘公共交通工具,减少私家车的使用 |
| C、减少食物加工过程 |
| D、大量使用薪柴为燃料 |
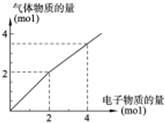 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为