题目内容
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素.
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子.用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为 .
(2)Q元素在元素周期表中属于 区,与Y元素同族的第四周期元素的价电子排布式为 .
(3)RY2的电子式为 ,Z3+的离子结构示意图为 .
(4)RQ2Y2的结构式为 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为 g.
(5)由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质.该反应的离子方程式为 .
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子.用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为
(2)Q元素在元素周期表中属于
(3)RY2的电子式为
(4)RQ2Y2的结构式为
(5)由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质.该反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,结合原子的结构和性质解答.
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,结合原子的结构和性质解答.
解答:
解:Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,
综上所述:Q为氢,R为碳,X为氮,Y为氧,Z为铬,
(1)C、N、O的第一电离取决于元素非金属性的强弱,但是由于N的2p能级上电子处于半充满的相对稳定状态,故C、N、O的第一电离能由大到小的顺序为N>O>C,
故答案为:N>O>C;
(2)Q元素为H,H在元素周期表中属于第一周期第ⅠA族,即s区,Y为O,与O元素同族(最外层电子数为6)的第四周期元素的价电子排布式为为:4s24p4,
故答案为:s;4s24p4;
(3)RY2为CO2,二氧化碳中,C与O形成两对共用电子对,故电子式为: ,Z3+的原子结构示意图为:
,Z3+的原子结构示意图为: ,
,
故答案为: ;
; ;
;
(4)RQ2Y2为:CH2O2,即甲酸,甲酸的结构式为: ,
,
甲酸燃烧生成二氧化碳和水,2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
HCOOH~CO2+H2O~△m
46 62 30
m x
x=
,故燃烧m g甲酸完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为:
,
故答案为: ;
;
;
(5)O、Cr两种元素组成的Cr2O72-离子在酸性条件下可与乙醇反应,生成乙酸、Cr3+等物质.该反应的离子方程式为2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O,故答案为:2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O.
①Q为元素周期表中原子半径最小的元素,则Q为H元素;
②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1S、2S、2P能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
R、X、Y原子序数依次增大,故X为氮;
④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,故Z的原子序数是24,所以Z为Cr元素,
综上所述:Q为氢,R为碳,X为氮,Y为氧,Z为铬,
(1)C、N、O的第一电离取决于元素非金属性的强弱,但是由于N的2p能级上电子处于半充满的相对稳定状态,故C、N、O的第一电离能由大到小的顺序为N>O>C,
故答案为:N>O>C;
(2)Q元素为H,H在元素周期表中属于第一周期第ⅠA族,即s区,Y为O,与O元素同族(最外层电子数为6)的第四周期元素的价电子排布式为为:4s24p4,
故答案为:s;4s24p4;
(3)RY2为CO2,二氧化碳中,C与O形成两对共用电子对,故电子式为:
 ,Z3+的原子结构示意图为:
,Z3+的原子结构示意图为: ,
,故答案为:
 ;
; ;
; (4)RQ2Y2为:CH2O2,即甲酸,甲酸的结构式为:
 ,
,甲酸燃烧生成二氧化碳和水,2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
HCOOH~CO2+H2O~△m
46 62 30
m x
x=
| 15m |
| 23 |
| 15m |
| 23 |
故答案为:
 ;
;| 15m |
| 23 |
(5)O、Cr两种元素组成的Cr2O72-离子在酸性条件下可与乙醇反应,生成乙酸、Cr3+等物质.该反应的离子方程式为2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O,故答案为:2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O.
点评:本题考查了物质结构和性质,元素周期律的知识,这些知识点是学习重点,根据原子结构正确判断元素是解本题关键,再结合基本概念、基本规律等知识点来分析解答,难度较大.

练习册系列答案
相关题目
要使溶液中存在大量的K+、Na+、H+、NO3-和SO42-五种离子,则在蒸馏水中至少溶解几种物质( )
| A、2种 | B、3种 | C、4种 | D、5种 |
硝酸见光发生如下分解反应:4HNO3═2H2O+4X↑+O2↑,则X的化学式为( )
| A、SO2 |
| B、N2O |
| C、NO |
| D、NO2 |
在一定温度下,定容密闭容器中发生反应:H2(g)+I2(g)?2HI(g),下列能说明反应已达平衡状态的是( )
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |
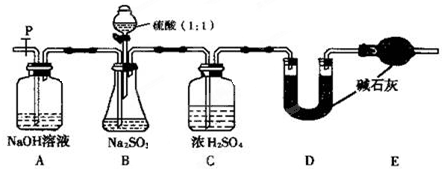
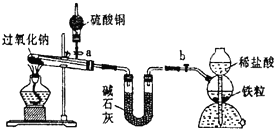 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.