题目内容
12.己二酸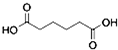 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: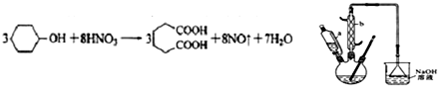
可能用到的有关数据如表:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)仪器a的名称为恒压滴液漏斗.
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管,或放热过多可能引起爆炸,或产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为(写一个即可):2NO2+Na2CO3═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
分析 (1)依据仪器的构造可知:仪器a的名称为:恒压滴液漏斗;
(2)环己醇的滴入速率过快,反应过快,该反应放热,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(3)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,据此写反应的化学方程式;
(4)产品己二酸中含有环己醇、硝酸等杂质,根据己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯分析;
(5)粗产品依据溶解度差别,可以通过重结晶可以提纯;依据反应的环己醇为5.4mL,质量=5.4ml×0.962g/ml=5.1948g,结合化学方程式计算理论上上城己二酸的质量,产率=$\frac{实际量}{理论量}$×100%.
解答 解:(1)依据仪器的构造可知:仪器a的名称为:恒压滴液漏斗,
故答案为:恒压滴液漏斗;
(2)向三口烧瓶中滴加环己醇时,反应温度迅速上升,说明该反应为放热反应,需控制好环己醇的滴入速率,如果环己醇的滴入速率过快,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中,
故答案为:反应液暴沸冲出冷凝管,或放热过多可能引起爆炸,或产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(3)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,反应的化学方程式为①NO+NO2+Na2CO3═2NaNO2+CO2,②Na2CO3+2NO2═NaNO2+NaNO3+CO2,
故答案为:2NO2+Na2CO3═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失,
故答案为:苯;
(5)粗产品再溶解,再结晶析出,通过重结晶的方法提纯己二酸,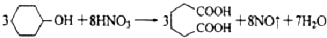
3×100 3×146
5.1948g m
m=7.58g
己二酸产率=$\frac{5.7g}{7.58g}$×100%=75%,
故答案为:重结晶;75%.
点评 本题考查实验室合成己二酸,涉及仪器识别、物质的分离与提纯、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 紫外线 | B. | 福尔马林 | C. | 硫酸钠 | D. | 浓盐酸 |
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是
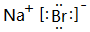 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
| A. | 2-甲基-3-己炔 | B. | 2-甲基丙烷 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-2-丁烯 |
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |

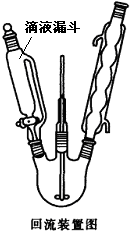 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下: