题目内容
7.关于VA族元素(用R代表)的下列叙述正确的是( )| A. | 氢化物的通式为 RH5 | B. | 最高化合价是+5 价 | ||
| C. | 非金属性由上到下递增 | D. | 其最高价含氧酸均为强酸 |
分析 A、氮族元素最外层5个电子,化合物为-3价;
B、氮族元素最外层电子排布式为ns2np3,最高化合价等于最外层电子;
C、非金属性由上到下递减;
D、非金属性越强最高价氧化物对应水化物的酸性越强;
解答 解:A.氮族元素氢化物的通式为RH3,故A错误;
B、氮族元素最外层电子排布式为ns2np3,最高化合价等于最外层电子,所以最高化合价是+5 价,故B正确;
C.随着电子层数增多,得电子越来越困难,非金属性由上到下递减,故C错误;
D、非金属性由上到下递减,磷酸是弱酸,故D错误;
故选B.
点评 本题考查氮族元素的性质,难度不大,注意知识的积累.

练习册系列答案
相关题目
18.反应A(g)+3B(g)?2C(g)+2D(g) 在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.01mol/(L•s) | ||
| C. | v(C)=0.40mol/(L•min) | D. | v(D)=0.45mol/(L•min) |
15.相同条件下,M、N气体的质量随体积变化关系如图所示,则M、N两气体的摩尔质量之比为( )


| A. | 1:1 | B. | 2:7 | C. | 7:4 | D. | 7:2 |
2.下列各组粒子属于同位素的是( )
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{19}^{40}$ K 和${\;}_{20}^{40}$ Ca | ||
| C. | O2 和 O3 | D. | H2O 和 D2O |
12.图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )


| A. | 通入 H2电极是负极 | |
| B. | 通入 O2电极发生氧化反应 | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
19.已知Fe3O4可表示成FeO•Fe2O3,水热法制备Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.下列说法正确的是( )
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子数为2 mol | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
16.X、Y、Z、W为四种短周期主族元素,四种元素的质子数之和为38.已知Y是空气中含量最高的元素,Z元素原子核外K层与M层电子数相等.W的单质常用来焊接钢轨.则下列说法中正确的是( )
| A. | Y元素最高价氧化物对应的水化物化学式为H3YO4 | |
| B. | 原子半径由大到小的顺序为W>Z>Y>X | |
| C. | X、Z两种元素的氧化物中所含化学键类型相同 | |
| D. | 与同浓度的盐酸反应,Z比W更剧烈 |
1.MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
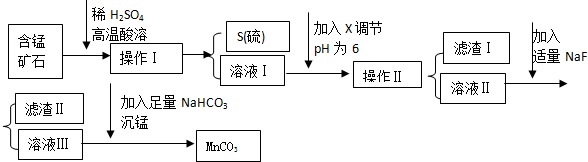
回答下列问题:
(1)操作Ⅰ为:过滤.
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O
(3)调节溶液pH所用物质X最好为C
A.NaOH溶液 B.氨水 C.MnCO3固体 D.盐酸
(4)滤渣Ⅰ为Al(OH)3、Fe(OH)3,滤渣Ⅱ为CaF2.
(5)沉锰的化学方程式为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑.
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:LiMn2O4-xe-=Li1-xMn2O4+xLi+.

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
(1)操作Ⅰ为:过滤.
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O
(3)调节溶液pH所用物质X最好为C
A.NaOH溶液 B.氨水 C.MnCO3固体 D.盐酸
(4)滤渣Ⅰ为Al(OH)3、Fe(OH)3,滤渣Ⅱ为CaF2.
(5)沉锰的化学方程式为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑.
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:LiMn2O4-xe-=Li1-xMn2O4+xLi+.
 或Na+[:H]-(写一例)
或Na+[:H]-(写一例)