题目内容
1.MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下: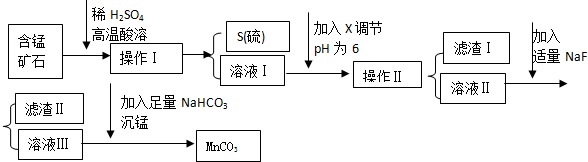
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
(1)操作Ⅰ为:过滤.
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O
(3)调节溶液pH所用物质X最好为C
A.NaOH溶液 B.氨水 C.MnCO3固体 D.盐酸
(4)滤渣Ⅰ为Al(OH)3、Fe(OH)3,滤渣Ⅱ为CaF2.
(5)沉锰的化学方程式为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑.
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:LiMn2O4-xe-=Li1-xMn2O4+xLi+.
分析 锰矿石的主要成分是MnO2还含CaO、Al2O3、FeS等杂质,加入稀硫酸高温酸溶,二氧化锰将氯化亚铁氧化成硫单质、铁离子,同时氧化钙和氧化铝与稀硫酸反应,通过操作Ⅰ过滤得到S沉淀和含有锰离子、铁离子、钙离子和铝离子的滤液Ⅰ;通过调节滤液Ⅰ的pH,将铝离子、铁离子转化成Al(OH)3、Fe(OH)3,过滤后分离出Al(OH)3、Fe(OH)3,滤液Ⅱ中含有钙离子和锰离子,加入NaF后将钙离子转化成CaF2沉淀,过滤后得到滤渣Ⅱ(CaF2沉淀)和滤液Ⅲ(主要含有硫酸锰),再加入碳酸氢钠,发生反应:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,从而获得MnCO3,
(1)操作Ⅰ得到的是S单质的沉淀,据此判断分离方法;
(2)溶液Ⅰ加入KSCN溶液呈现红色,说明有铁离子存在,据此写出在酸溶过程中FeS发生反应的离子方程式;
(3)除杂时由于不能引进杂质,则调节溶液的pH所用的物质最好为MnCO3;
(4)根据表中数据分析可得到当pH=6的时候,铁离子和铝离子会完全沉淀,据此可知滤渣成分;滤液中还会含有钙离子,加入NaF后转化成CaF2沉淀;
(5)沉锰是利用碳酸氢钠与硫酸锰反应生成碳酸锰沉淀,据此写出反应的化学方程式;
(6)MnCO3也是制造锂离子电池的重要原料,在此电池充电过程中正极发生LiMn2O4失去电子写生成Li1-xMn2O4,据此写出该电池充电时正极发生的反应式.
解答 解:锰矿石的主要成分是MnO2还含CaO、Al2O3、FeS等杂质,加入稀硫酸高温酸溶,二氧化锰将氯化亚铁氧化成硫单质、铁离子,同时氧化钙和氧化铝与稀硫酸反应,通过操作Ⅰ过滤得到S沉淀和含有锰离子、铁离子、钙离子和铝离子的滤液Ⅰ;通过调节滤液Ⅰ的pH,将铝离子、铁离子转化成Al(OH)3、Fe(OH)3,过滤后分离出Al(OH)3、Fe(OH)3,滤液Ⅱ中含有钙离子和锰离子,加入NaF后将钙离子转化成CaF2沉淀,过滤后得到滤渣Ⅱ(CaF2沉淀)和滤液Ⅲ(主要含有硫酸锰),再加入碳酸氢钠,发生反应:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,从而获得MnCO3,
(1)操作Ⅰ得到的是S单质的沉淀,该物质分离的方法为过滤,
故答案为:过滤;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈现红色,说明有铁离子存在,所以在酸溶过程中FeS发生反应的离子方程式:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O,
故答案为:FeS+12H++3MnO2$\frac{\underline{\;高温\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O;
(3)由于不能引进杂质,则调节溶液的pH所用的物质X最好为MnCO3固体,故C正确,
故答案为:C;
(4)根据表中数据分析可得到当pH=6的时候,铁离子和铝离子会完全沉淀,因此滤渣为Al(OH)3、Fe(OH)3;
滤液中还会含有钙离子,则加入NaF后转化成CaF2沉淀,
故答案为:Al(OH)3、Fe(OH)3;CaF2;
(5)滤液Ⅲ中含有硫酸锰,硫酸锰与碳酸氢钠溶液反应生成碳酸锰沉淀、硫酸钠、二氧化碳和水,反应的化学方程式为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,
故答案为:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑;
(6)MnCO3也是制造锂离子电池的重要原料,在此电池充电过程中正极发生LiMn2O4失去电子的氧化反应,该电池充电时正极发生的反应式为:LiMn2O4-xe-=Li1-xMn2O4+xLi+,
故答案为:LiMn2O4-xe-=Li1-xMn2O4+xLi+.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确实验目的、制备原理为解答关键,注意掌握化学实验基本操作方法,试题有利于提高学生的分析、理解能力及化学实验能力.

| A. | 氢化物的通式为 RH5 | B. | 最高化合价是+5 价 | ||
| C. | 非金属性由上到下递增 | D. | 其最高价含氧酸均为强酸 |
| A. | SO2具有氧化性,可用于漂白纸浆 | B. | NH4HCO3含有氮元素,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | D. | Al2O3硬度大,可用作耐高温材料 |
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2 | |
| B. | 氧化铜与硫酸反应:O2-+2 H+═H2O | |
| C. | 硫酸钠和氯化钡两种溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 盐酸与石灰石反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(2)C的氢化物的电子式为
 .
.(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O;
(4)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式);
(5)C、E形成的化合物为SO2、SO3(填化学式)
(6)用电子式表示AD形成化合物的过程:
 .
.