题目内容
20.下列陈述正确并且有因果关系的是( )| A. | SO2有漂白性,因而SO2可使溴水褪色 | |
| B. | Cl2有漂白性,因而Cl2能使品红溶液褪色 | |
| C. | 浓硫酸有吸水性,因而浓硫酸可用于干燥H2和CO | |
| D. | Fe3+有强氧化性,因而FeCl3溶液可用于回收废旧电路板中的铜 |
分析 A.二氧化硫具有还原性,能够还原溴水,使溴水褪色;
B.氯气不具有漂白性;
C.依据浓硫酸的吸水性解答;
D.三价铁离子能够氧化铜生成二价铁离子和铜离子;
解答 解:A.SO2可使溴水褪色,体现二氧化硫的还原性,故A错误;
B.Cl2不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,因而Cl2能使品红溶液褪色,故B错误;
C.浓硫酸可用于干燥H2和CO,体现浓硫酸的干燥性,故C正确;
D.Fe3+有强氧化性,能够氧化铜生成二价铁离子和铜离子,因而FeCl3溶液可用于回收废旧电路板中的铜,故D正确;
故选:CD.
点评 本题考查了元素化合物知识,涉及氯气、二氧化硫、三价铁离子、浓硫酸的性质是解题关键,熟悉相关物质的性质是解题关键,题目难度不大.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 0.1 mol•L-1 | B. | 0.15 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
| A. | 夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 实验室用托盘天平称量烧碱时,为防止腐蚀托盘,需在托盘上垫上小纸片 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
( )
| A. | HCO3-、Al3+、Na+、SO42- | B. | I-、NO3-、K+、NH4+ | ||
| C. | MnO4-、Cl-、SO42-、K+ | D. | SiO32-、SO32-、Na+、Cl- |
| A. | Na和O2 | B. | NaOH溶液和CO2 | ||
| C. | Na2O2和CO2 | D. | NaOH溶液和Ca(HCO3)2溶液 |
⑴反应Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) △H1,平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) △H2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g) CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g)+H2O(g) △H,平衡常数为K,则△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是 反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是 (填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
⑵一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示。
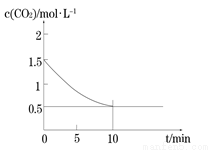
① 该条件下反应的平衡常数为 ;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为_________mol·L-1。
②下列措施中能使平衡时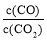 增大的是_________(填序号)。
增大的是_________(填序号)。
A.升高温度 B.增大压强 C.充入一定量的CO2 D.再加入一定量铁粉