题目内容
按如图装置进行实验,并回答下列问题

(1)锌极为 极,
(2)石墨棒C1电极反应式为 ,
(3)石墨棒C2附近发生的实验现象为 ;
(4)当C2极析出224mL气体(标准状态)时,转移电子 moL.

(1)锌极为
(2)石墨棒C1电极反应式为
(3)石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL气体(标准状态)时,转移电子
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)有外加电源的是电解池,没有外加电源的是原电池或者根据原电池和电解池的构成条件来回答;
(2)石墨棒C1和原电池的正极相连,为氯离子失电子;
(3)石墨棒C2和原电池的负极相连,氢离子得电子发生还原反应;
(4)根据电子守恒定律来计算回答.
(2)石墨棒C1和原电池的正极相连,为氯离子失电子;
(3)石墨棒C2和原电池的负极相连,氢离子得电子发生还原反应;
(4)根据电子守恒定律来计算回答.
解答:
解:(1)装置A符合原电池的构成条件属于原电池,Zn失电子族负极,
故答案为:负;
(2)石墨棒C1和原电池的正极相连,是阳极,氯离子在该极发生失电子的氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(3)石墨棒C2和原电池的负极相连,是阴极,氢离子放电,所以氢离子浓度减小而氢氧根浓度增大,碱性增强,使酚酞变红,
故答案为:电极上有气泡产生,无色溶液变红色;
(4)C2极发生的电极反应为:2H++2e-→H2↑,析出224mL(即0.01mol)气体(标准状态)时,转移电子数是0.02mol,所以锌极转移电子也为0.02mol,
故答案为:0.02.
故答案为:负;
(2)石墨棒C1和原电池的正极相连,是阳极,氯离子在该极发生失电子的氧化反应,即2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
(3)石墨棒C2和原电池的负极相连,是阴极,氢离子放电,所以氢离子浓度减小而氢氧根浓度增大,碱性增强,使酚酞变红,
故答案为:电极上有气泡产生,无色溶液变红色;
(4)C2极发生的电极反应为:2H++2e-→H2↑,析出224mL(即0.01mol)气体(标准状态)时,转移电子数是0.02mol,所以锌极转移电子也为0.02mol,
故答案为:0.02.
点评:本题考查了原电池和电解池原理的应用,把握原电池和电解池的工作原理以及电子守恒原理,难度不大.

练习册系列答案
相关题目
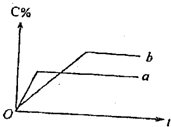 如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )
如图表示可逆反应A(固)+B(气)?nC(气);反应的热效应为Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需要的关系曲线.下列有关叙述一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b表示没有使用催化剂 |
| B、其他条件相同,若只改变温度,则a比b的温度高且正反应吸热 |
| C、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D、其他条件相同,若只改变A物质的量,则a比b用A物质的量少 |
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4溶液;电源有a、b两极.若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,实验现象如图所示,下列说法正确的是( )


| A、电源中a为正极,b为负极 |
| B、试管A中的电极反应式为:2H++2e-=H2↑ |
| C、一段时间后滤纸条上紫红色向C处移动 |
| D、电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转 |

 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛.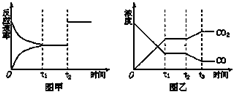 已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,
已知:反应①Fe(s)+CO2(g)?FeO(s)+CO(g);△H=Q1,平衡常数为K1,