题目内容
在密闭容器中发生下列反应:xA g)+y B(g)?zC(g),平衡时测得A的浓度为 0.5mol/L,保持温度不变,将容器的容积压缩到原来的
,再达平衡时测得A的浓度为 0.8mol/L,下列判断正确的是( )
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、x+y>z |
| C、B的物质的量增大 |
| D、C的体积分数保持不变 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积压缩到原来的
,如平衡不移动,则A的浓度应降低为1.0mol/L,而此时为0.8mol/L,则说明增大压强平衡向正方向移动,以此进行判断.
| 1 |
| 2 |
解答:
解:平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积压缩到原来的
,如平衡不移动,则A的浓度应升高为1.0mol/L,而此时实际A的浓度为0.8mol/L,则说明增大压强平衡向正方向移动,则:
A、由以上分析可知平衡向正方向移动,故A错误;
B、增大压强平衡向正方向移动,说明该反应是正向是气体体积减小的反应,应为x+y>z,故B正确;
C、平衡向正方向移动,B的转化率增大,物质的量减小,故C错误;
D、平衡向正方向移动,C的体积分数增大,故D错误.
故选B.
| 1 |
| 2 |
A、由以上分析可知平衡向正方向移动,故A错误;
B、增大压强平衡向正方向移动,说明该反应是正向是气体体积减小的反应,应为x+y>z,故B正确;
C、平衡向正方向移动,B的转化率增大,物质的量减小,故C错误;
D、平衡向正方向移动,C的体积分数增大,故D错误.
故选B.
点评:本题考查化学平衡移动知识,题目难度不大,注意从浓度的变化的角度判断平衡移动的方向,结合压强对平衡移动的影响分析.

练习册系列答案
相关题目
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+
O2(g)△H=-226kJ?mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、1.4g CO完全燃烧放出热量为28.3kJ |
| B、CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ?mol-1 |
| C、2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452kJ?mol-1 |
| D、CO2(g)与Na2O2(s)反应放出226kJ热量时,电子转移为2×6.02×1023 |
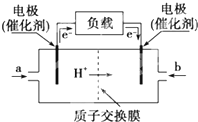 如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )
如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经过电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2═2CO2+4H2O.下列有关该电池的说法错误的是( )| A、右边的电极为电池的负极,b处通入的是空气 |
| B、左边的电极为电池的负极,a处通入的是甲醇 |
| C、电池负极的反应式为:2CH3OH+2H2O-12e-═2CO2↑+12H+ |
| D、电池正极的反应式为:3O2+12H++12e-═6H2O |
在一定温度下容积恒定的密闭容器中,充入2mol A、1mol B和4mol M,发生如下反应:2A(g)+B(g)+M(s)═xC(g),达到平衡后C的体积分数为a%.若在相同条件下,x分别为2或3时,均按起始物质的量为0.6mol A、0.3mol B、1.4mol C、2mol M充入容器中,分别达到平衡状态,两平衡状态中C的体积分数为( )
| A、两者都小于a% |
| B、两者都大于a% |
| C、两者都等于a% |
| D、无法确定 |
金属的下列性质中与金属晶体结构无关的是( )
| A、导电性 | B、化学反应中易失去电子 |
| C、延展性 | D、硬度 |
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):
请计算H2(g)+Cl2(g)═2HCl(g)的反应热( )
| 化学键 | H-H | Cl-Cl | Cl-H |
| 键能/(kJ?mol-1) | 436 | 243 | 431 |
| A、+862 kJ?mol-1 |
| B、+679 kJ?mol-1 |
| C、-183 kJ?mol-1 |
| D、+183 kJ?mol-1 |
分子式为C4H8Cl2,结构中仅含一个-CH3的同分异构体共有(不考虑立体异构( )
| A、6种 | B、5种 | C、4种 | D、3种 |
下列反应中,不属于氧化---还原反应的是( )
A、C+O2
| ||||
B、CH4+2O2
| ||||
| C、CaO+H2O=Ca(OH)2 | ||||
D、CuO+H2
|