题目内容
草酸亚铁晶体(FeC2O4?2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产.回答下列问题:
I兴趣小组对草酸亚铁晶体的分解产物进行实验和探究.探究分解得到的固体产物中铁元素的存在形式.
(1)提出假设
假设一: ;假设二:全部是FeO;假设三:FeO和Fe混合物.
(2)设计实验方案证明假设三.
限选试剂:稀盐酸、新制的氯水、0.1mol?L-1CuSO4溶液、20% KSCN溶液、蒸馏水.
Ⅱ兴趣小组在文献中查阅到,FeC204?2H20受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC204?2H20晶体受热分解的化学方程式为:
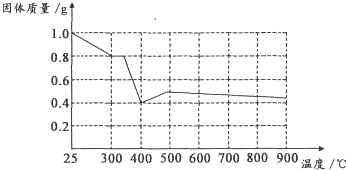
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设二不成立.你是否同意该同学的结论,并简述理由: .
I兴趣小组对草酸亚铁晶体的分解产物进行实验和探究.探究分解得到的固体产物中铁元素的存在形式.
(1)提出假设
假设一:
(2)设计实验方案证明假设三.
限选试剂:稀盐酸、新制的氯水、0.1mol?L-1CuSO4溶液、20% KSCN溶液、蒸馏水.
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 | 若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中滴加 |

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设二不成立.你是否同意该同学的结论,并简述理由:
考点:性质实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:Ⅰ.(1)依据假设2、3分析假设1的内容;
(2)依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ.氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
定量实验:根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化;
Ⅱ.根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.
(2)依据假设3是铁和氧化亚铁的混合物,利用硫酸铜溶液和铁反应生成铜的现象分析证明铁的存在,过滤后用蒸馏水洗涤,取固体用盐酸溶解后加入过氧化氢氧化为铁离子,加入硫氰酸钾溶液若出现血红色现象证明含有氧化亚铁,据此设计实验步骤检验;
Ⅱ.氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
定量实验:根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化;
Ⅱ.根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g.某同学由此得出结论:假设一不成立不合理,氧化亚铁可以被空气氧化.
解答:
解Ⅰ:(1)假设2:FeO; 假设3:FeO和Fe混合物,则假设1为Fe,
故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
;
II.通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4?2H2O
FeC2O4+(2-x)H2O+xH2O△m
180 18x
1.0 0.2
解得:x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式为:FeC2O4
FeO+CO+CO2,分析图象可知;
FeC2O4
FeO+CO+CO2 △m
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为:FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O;
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,所以“某同学由此得出结论:假设一不成立”不合理,
故答案为:FeC2O4.2H2O
FeO+CO↑+CO2↑+2H2O;不同意,实验未在密闭容器中进行,FeO会被空气进一步氧化,生成铁的其它氧化物.
故答案为:Fe;
②依据题干所提供的试剂结合假设3的混合物组成为铁和氧化亚铁的性质分析设计实验步骤为,向试管中加入少量固体产物,再加入足量硫酸铜溶液,充分振荡,若溶液颜色明显改变,且有暗红色固体物质生成证明有铁单质存在,将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色,取步骤2得到的少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN,若溶液呈血红色证明含有氧化亚铁,
故答案为:
| 实验步骤 | 现象与结论 |
| 步骤1:硫酸铜溶液 | (暗)红色固体 |
| 步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水,充分振荡 | 若滴加适量新制的氯水后溶液呈红色,则证明有FeO |
II.通过剩余固体的质量可知,过程Ⅰ发生的反应是:草酸亚铁晶体受热失去结晶水,设失去结晶水x,图象分析可知固体质量变化1.0-0.8=0.2g,依据则反应的化学方程式计算为:
FeC2O4?2H2O
| ||
180 18x
1.0 0.2
解得:x=2
加热到300°C,晶体全部失去结晶水生成草酸亚铁和水,
继续加热到400°C,固体质量减少0.8g-0.4g=0.4g;此时草酸亚铁分解减少的是气体质量,反应过程中一定存在反应生成氧化亚铁和二氧化碳,铁元素化合价不变时,依据元素化合价变化和电子守恒可知碳元素化合价从+3价变化为+4价,一定有化合价降低生成+2价的一氧化碳,反应的化学方程式为:FeC2O4
| ||
FeC2O4
| ||
144 72
0.8 0.4
计算结果符合图象固体质量变化,所以反应的化学方程式为:FeC2O4.2H2O
| ||
如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,依据铁元素守恒计算得到若生成氧化亚铁,质量为0.4g,但实验过程中最终残留黑色固体的质量大于0.4g,可能是实验未在密闭容器中进行,氧化亚铁被空气氧化为氧化铁,所以“某同学由此得出结论:假设一不成立”不合理,
故答案为:FeC2O4.2H2O
| ||
点评:本题考查了探究物质组成、测量物质含量及性质实验方案的设计,题目难度中等,注意掌握物质的性质及检验方法,(II)为易错点,正确分析曲线变化为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
下列说法或有关化学用语的表达正确的是( )
| A、在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B、基态Fe原子的外围电子排布图为: |
| C、因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D、根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
有关如图所示化合物的说法不正确的是( )


| A、该有机物的分子式为C15H18O4 |
| B、1mol该化合物最多可以与2molNaOH反应 |
| C、既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D、既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |

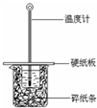 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.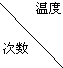
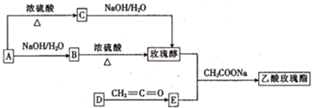
 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
