题目内容
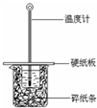 某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸反应来测定中和热,实验装置如图所示.(1)大、小烧杯间填满碎纸条的作用是
(2)图示实验装置中缺少的一种仪器是
(3)取50mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.3 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.0 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.6 | |
③氢氧化钠溶液稍过量的原因是
④上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取盐酸时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度.
考点:中和热的测定
专题:实验题
分析:(1)根据中和热的实验的关键是保温;
(2)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;金属导热快,热量损失多;
(3)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热;
③氢氧化钠溶液稍过量的原因是保证盐酸能够完全被中和;
④a.装置保温、隔热效果差,测得的热量偏小;
b.量取盐酸溶液的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
(2)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;金属导热快,热量损失多;
(3)①先判断温度差的有效性,然后求出温度差平均值;
②根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
③氢氧化钠溶液稍过量的原因是保证盐酸能够完全被中和;
④a.装置保温、隔热效果差,测得的热量偏小;
b.量取盐酸溶液的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
解答:
解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:减少实验过程中的热量损失;
故答案为:保温、隔热防止热量散失;
(2)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大;
故答案为:环形玻璃搅拌棒;否;铜丝有良好的导热性,加快热量的散失;
(3)①3次温度差分别为:3.2℃,3.1℃,3.3℃,三次温度差平均值=
=3.2℃,故答案为:3.2;
②50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L盐酸溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值为△T=3.2℃,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.2℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=
=-53.5kJ/mol,
故答案为:-53.5kJ/mol;
③酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证盐酸溶液完全被中和,从而提高实验的准确度,
故答案为:保证盐酸能够完全被中和;
④a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取盐酸溶液的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确;
故答案为:acd.
故答案为:保温、隔热防止热量散失;
(2)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大;
故答案为:环形玻璃搅拌棒;否;铜丝有良好的导热性,加快热量的散失;
(3)①3次温度差分别为:3.2℃,3.1℃,3.3℃,三次温度差平均值=
| 3.2℃+3.1℃+3.3℃ |
| 3 |
②50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L盐酸溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值为△T=3.2℃,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.2℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=
| 1.3376KJ |
| 0.025mol |
故答案为:-53.5kJ/mol;
③酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差,所以实验中NaOH过量,为了能保证盐酸溶液完全被中和,从而提高实验的准确度,
故答案为:保证盐酸能够完全被中和;
④a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取盐酸溶液的体积时仰视读数,会导致所量的盐酸体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确;
故答案为:acd.
点评:本题考查热中和热概念、测定原理及反应热的计算,题目难度中等,注意理解中和热的概念以及测定反应热的误差等问题.

练习册系列答案
相关题目
一固体混和物,可能有氯化钙、碳酸铵、烧碱、硫酸铵,将它溶解于水得到无色澄清溶液,无其它明显现象,向溶液中加入硝酸钡溶液,产生白色沉淀,再加入硝酸,沉淀部分消失,原混和物中肯定有( )
| A、CaCl2 和(NH4)2SO4 |
| B、(NH4)2SO4 和(NH4)2CO3 |
| C、NaOH和CaCl2 |
| D、NaOH和(NH4)2SO4 |
下列说法正确的是( )
| A、明矾[KAl(SO4)2?12H2O]溶解在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、玻璃具有耐腐蚀性,可以用玻璃试剂瓶长期保存酸、碱溶液 |
| C、浓H2SO4有强氧化性,但常温下可以用铁槽车运输 |
| D、将SO2通入溴水,溴水褪色后加热能恢复原色 |
下列关于常见有机化合物的说法中,正确的是( )
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
 某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.
某学生用如图装置进行一氧化碳和二氧化碳混合气体的分离提纯及干燥.其中a为弹簧夹,b为分液漏斗的活塞.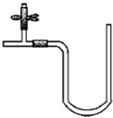 “阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.