题目内容
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、7.8gNaS和 Na2O2中含有的阴离子数等于0.1NA |
| C、50mL18.4mol L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
| D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
考点:阿伏加德罗常数
专题:
分析:A.铁与氯气反应生成氯化铁,5.6g铁粉在0.1mol氯气中充分燃烧,氯气不足,转移电子数,依据氯气计算;
B.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
C.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应;
D.二氧化氮和四氧化二氮最简式相同,都是NO2,将质量转化为物质的量,依次解答.
B.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
C.Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应;
D.二氧化氮和四氧化二氮最简式相同,都是NO2,将质量转化为物质的量,依次解答.
解答:
解:A.5.6g铁粉在0.1mol氯气中充分燃烧,氯气不足,完全反应,转移电子数为0.2NA,故A错误;
B.7.8gNaS和 Na2O2中的物质的量,均为0.1mol,过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,硫化钠中阴离子为硫离子,含有的阴离子数等于0.1NA,故B正确;
C.50mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.05L×18.4mol/L=0.92mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=0.92mol×
=0.46mol,由于Cu与浓硫酸反应,随反应进行,浓硫酸变稀,Cu不与稀硫酸反应,故实际得到SO2小于0.46mol,故C错误;
D.NO2和N2O4的最简式相同为NO2,计算46gNO2中原子数=
×3×NA=3NA,46g的NO2和N2O4混合气体含有的原子数为3NA,故D正确;
故选:BD.
B.7.8gNaS和 Na2O2中的物质的量,均为0.1mol,过氧化钠中阴离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,硫化钠中阴离子为硫离子,含有的阴离子数等于0.1NA,故B正确;
C.50mL 18.4mol/L的浓硫酸中H2SO4的物质的量=0.05L×18.4mol/L=0.92mol,若硫酸完全反应,由方程式可知生成二氧化碳的物质的量=0.92mol×
| 1 |
| 2 |
D.NO2和N2O4的最简式相同为NO2,计算46gNO2中原子数=
| 46g |
| 46g/mol |
故选:BD.
点评:本题考查了阿伏伽德罗常数的分析判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
下列关于常见有机化合物的说法中,正确的是( )
| A、蛋白质、葡萄糖和乙酸均属电解质 |
| B、甲烷和苯都能发生氧化反应和取代反应 |
| C、乙醇和乙酸分子中都含羟基,都能与NaOH发生反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
下列各组离子能大量共存的是( )
| A、加入KSCN显红色的溶液:K+、NH+4、Cl-、S2- |
| B、“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+ |
| C、pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
| D、无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
从海水中提取溴常用的一种工艺涉及以下过程:则正确的步骤为( )
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr.
| A、②①③④ | B、①②③④ |
| C、③②①④ | D、②①④③ |
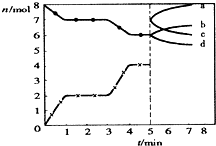 高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )
高温下进行反应:C(s)+CO2(g)?2CO(g)△H=xkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图:下列说法正确的是( )A、2min时,
| ||||
| B、0~lmin,v(CO)=1 mol/(L?min);1~3min时,v(CO)=v(CO2) | ||||
| C、3min时温度由T1升高到T2,则x>O | ||||
| D、5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化 |