题目内容
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
考点:离子方程式的书写
专题:
分析:A.稀硝酸具有氧化性,能够氧化亚铁离子和硫离子;
B.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应;
C.次氯酸盐和二氧化碳、水反应生成次氯酸和碳酸盐;
D.二者反应生成醋酸钙、二氧化碳和水.
B.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应;
C.次氯酸盐和二氧化碳、水反应生成次氯酸和碳酸盐;
D.二者反应生成醋酸钙、二氧化碳和水.
解答:
解:A.硫化亚铁溶于稀硝酸中,发生氧化还原反应,正确的离子方程式为:FeS+4H++NO3-=Fe3++S↓+NO↑+2H2O,故A错误;
B.NH4HCO3溶于过量的NaOH溶液中,正确的离子方程式为:NH4++HCO3-+2OH-=CO32-+H2O+NH3?H2O,故B错误;
C.次氯酸盐和二氧化碳、水反应生成次氯酸和碳酸盐,正确的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32-,故C错误;
D.大理石和醋酸反应生成醋酸钙、二氧化碳和水,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
B.NH4HCO3溶于过量的NaOH溶液中,正确的离子方程式为:NH4++HCO3-+2OH-=CO32-+H2O+NH3?H2O,故B错误;
C.次氯酸盐和二氧化碳、水反应生成次氯酸和碳酸盐,正确的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32-,故C错误;
D.大理石和醋酸反应生成醋酸钙、二氧化碳和水,反应的离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列物质的水溶液能导电,但属于非电解质的是( )
| A、H2SO4 |
| B、C2H5OH |
| C、NH4SO4 |
| D、SO2 |
下列说法不正确的是( )
| A、分散质粒子直径介于1~100 nm之间的分散系称为胶体 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
下列反应的离子方程式正确的是( )
| A、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、明矾溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
关于Cl-的说法正确的是( )
| A、Cl-呈黄绿色 |
| B、Cl-有毒 |
| C、Cl-具有氧化性 |
| D、Cl-是稳定结构 |
要配制浓度约为2mol/LNaOH溶液100mL,下面的操作正确的是( )
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题: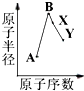 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.