题目内容
1.写出下列化学反应的离子方程式:(1)往MgCl2溶液中滴加AgNO3溶液Ag++Cl-=AgCl↓
(2)往K2CO3溶液中滴加稀盐酸2H++CO32-=H2O+CO2↑
(3)碳酸钠中加入CaCl2溶液产生白色沉淀Ca2++CO32-=CaCO3↓
(4)稀硫酸溶液中插入铁片,铁片上出现气泡Fe+2H+=Fe2++H2↑
(5)向氢氧化钡溶液中滴加稀硫酸Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
分析 (1)反应生成氯化银和硝酸镁;
(2)反应生成氯化钾、水、二氧化碳;
(3)反应生成氯化钠和碳酸钙;
(4)Fe与稀硫酸反应生成硫酸亚铁和氢气;
(5)反应生成硫酸钡和水.
解答 解:(1)反应生成氯化银和硝酸镁,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(2)反应生成氯化钾、水、二氧化碳,离子反应为2H++CO32-=H2O+CO2↑,故答案为:2H++CO32-=H2O+CO2↑;
(3)反应生成氯化钠和碳酸钙,离子反应为Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
(4)Fe与稀硫酸反应生成硫酸亚铁和氢气,离子反应为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(5)反应生成硫酸钡和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
点评 本题考查离子反应方程式的书写,为高考高频考点,把握发生的化学反应为解答的关键,注意离子反应的书写方法即可解答,侧重复分解反应的考查,题目难度不大.

练习册系列答案
相关题目
11. 常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
 常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=40ml时,溶液中存在c(OH-)=c(HT-)+2 c(H2T)+c(H+) |
16.欲除去氢氧化铁胶体中混有的Na+和Cl-,可选用的方法是( )
| A. | 过滤 | B. | 蒸馏 | ||
| C. | 用半透膜进行渗析 | D. | 蒸发 |
13.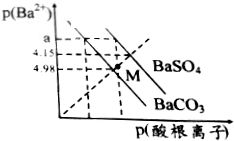 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
20.下列电子式正确的是( )
| A. | H2O2 | B. | MgCl2 | C. | NaOH  | D. | CCl4 |
