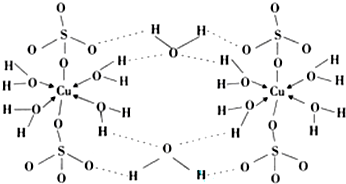
题目内容
15.短周期主族元素W、X、Y、Z的原子序数依次增大.元素W的原子内层电子数是最外层电子数的2倍,元素X的单质是电池常用的惰性电极材料,元素Y的原子最外层电子数等于电子层数,元素Z的原子最外层电子数是其电子层数的2倍.下列说法错误的是( )| A. | 化合物XZ2中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢元素能形成原子数目之比为1:1的化合物 | |
| C. | Y的单质与稀硫酸、浓硫酸均可发生氧化还原反应 | |
| D. | Z的单质在加热条件下会与Fe反应生成Fe3Z4 |
分析 短周期主族元素W、X、Y、Z的原子序数依次增大.元素X的单质是电池常用的惰性电极材料,则X为C元素;元素W的原子内层电子数是最外层电子数的2倍,则W为Li元素;元素Y的原子最外层电子数等于电子层数,Y原子序数大于C,在第三周期,则Y为Al元素;元素Z的原子最外层电子数是其电子层数的2倍,有3个电子层,最外层为6,即Z为S元素,据此分析.
解答 解:短周期主族元素W、X、Y、Z的原子序数依次增大.元素X的单质是电池常用的惰性电极材料,则X为C元素;元素W的原子内层电子数是最外层电子数的2倍,则W为Li元素;元素Y的原子最外层电子数等于电子层数,则Y为Al元素;元素Z的原子最外层电子数是其电子层数的2倍,有3个电子层,最外层为6,即Z为S元素,
A.化合物CS2的电子式为 ,各原子均满足8电子的稳定结构,故A正确;
,各原子均满足8电子的稳定结构,故A正确;
B.X为C元素,C与H能形成原子数目之比为1:1的化合物,如C2H2,故B正确;
C.W为Li元素,Li为活泼金属,与稀硫酸、浓硫酸均可发生氧化还原反应,故C正确;
D.S的单质在加热条件下会与Fe反应生成FeS,故D错误.
故选D.
点评 本题考查原子结构与元素周期律知识,侧重于物质结构与性质等方面的考查,难度不大,注意原子核外电子的排布特点,推断元素的种类为解答该题的关键.

练习册系列答案
相关题目
5.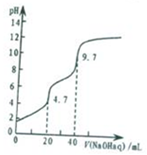 常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
 常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20mL0.1000mol•L-1 H3PO4溶液,滴定曲线如图所示,下列说法错误的是( )| A. | NaH2PO4溶液呈酸性 | |
| B. | pH=9.7处,c(Na+)>c(HPO42-)>c(OH-)>c(H+) | |
| C. | pH=4.7处,c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-) | |
| D. | 当2<pH<4.7时,H3PO4的第一步电离平衡常数均相等 |
10.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )
| A. | 火箭用偏二甲肼(C2H8N2)作燃料,N2O4作还原剂,反应产生巨大能量 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 硫是一种生命元素,自然界中的石膏矿、硫铁矿、赤铁矿等都是含“硫”为主的矿石 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
7.具有下列电子构型的元素-一位于周期表中s区的是( )
| A. | 最外层电子构型为ns2(n≠1),次外层电子数为8 | |
| B. | 外围电子构型为3d104s2 | |
| C. | 外围电子排布式为ns2np4 | |
| D. | 外围电子排布式为(n-1)d5ns2 |
5.下列离子方程式正确的是( )
| A. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 碳酸钙加入盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 向MgCl2溶液加入氨水:Mg2++2OH-═Mg(OH)2↓ |
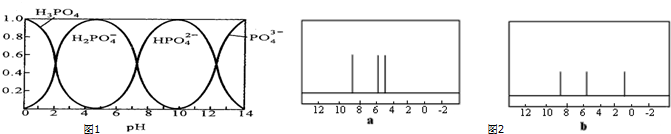
 ;分子N中含有2个手性碳原子.
;分子N中含有2个手性碳原子. .
.