题目内容
5. 实验室需要配制0.50mol/L NaCl溶液480mL.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管以及等质量的两片滤纸.
(2)计算.配制该溶液需取NaCl晶体14.6g.
(3)称量.
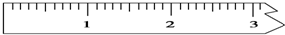
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是搅拌,加速NaCl溶解
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了保证溶质全部转移入容量瓶中.
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时仰视,所配溶液的浓度会偏低(填“偏高”、“偏低”或“无影响”).
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;
(2)要配制480mL溶液应选择500ml容量瓶,依据m=CVM计算需要氯化钠的质量;
(3)①砝码质量为14g,则游码的质量为0.6g,据此在图1中用一根竖线标出游码左边缘所处的位置;
②依据左物右码原则解答;
(4)溶解氯化钠时需要使用玻璃棒搅拌,加速氯化钠的溶解过程;
(5)转移溶液时需要使用玻璃棒引流,定容前还需要洗涤烧杯和玻璃棒,目的是将溶质全部转移到容量瓶中;
(8)在配制过程中,某学生观察定容时仰视,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤,用到的仪器有:托盘天平(精确到0.1g)、药匙、等质量的两片滤纸、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
故答案为:500ml容量瓶、胶头滴管;
(2)要配制0.50mol/L NaCl溶液500mL,需要氢氧化钠的质量m=0.5L×0.50mol/L×58.5g/mol=14.6;
故答案为:14.6;
(3)①称量时砝码质量为:10g×1+2g×2=14g,游码的质量为0.6g,则游码应该为: ,
,
故答案为: ;
;
②用托盘天平称量物质应遵循左物右码原则,所以称量过程中NaCl晶体应放于天平的左盘;
故答案为:左盘;
(4)溶解的实验中需要使用玻璃棒进行搅拌,加速氯化钠的溶解,
故答案为:搅拌,加速NaCl溶解;
(5)转移溶液时需要使用玻璃棒引流,避免溶液流到容量瓶以外;定容前还应该洗涤烧杯和玻璃棒,目的是将溶质全部转移到容量瓶中,
故答案为:玻璃棒;保证溶质全部转移入容量瓶中;
(8)在配制过程中,某学生观察定容时仰视,导致溶液体积偏大,依据C=$\frac{n}{V}$可知溶液浓度偏低,
故答案为:偏低.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度不大,试题基础性强,注意掌握配制一定物质的量难度的溶液方法.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案①对空气进行降温加压
②金刚石变成石墨
③NaCl熔化
④碘溶于CCl4中
⑤HCl溶于水电离出H+和Cl-
⑥电解熔融的Al2O3制取Al.
| A. | ②③⑤ | B. | ②⑤⑥ | C. | ②⑥ | D. | ②③⑤⑥ |
| A. | 大量使用LED节能路灯 | |
| B. | 鼓励市民驾驶私家车代替乘坐公交车出行 | |
| C. | 将煤液化、气化,提高燃料的燃烧效率 | |
| D. | 进一步推广使用乙醇汽油作为汽车的燃料 |
①定容时仰视刻度线
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切.
| A. | ②③④ | B. | ③④ | C. | ①②③④ | D. | ①②③ |
| A. | 苯分子中6个碳原子连接成平面正六边形 | |
| B. | 苯分子中6个碳碳化学键完全相同 | |
| C. | 苯跟浓硝酸、浓硫酸混合加热,可制得硝基苯 | |
| D. | 苯可以与溴水、酸性高锰酸钾溶液反应而使它们褪色 |
| A. | 容器中只有三氧化硫 | |
| B. | 18O原子存在于氧气、二氧化硫、三氧化硫中 | |
| C. | 生成2 mol 三氧化硫 | |
| D. | 18O原子完全存在于三氧化硫中 |
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 混合物 |