题目内容
19. 如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:
如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:(1)在达到平衡状态A的容器中通入少量O2,体系中SO2的体积分数减小(填“增大”或“减小”或“不变”),若要使SO2的体积分数再变到与平衡状态A相同,可采取的措施有:通入适量SO2或者给体系升温.
(2)在该平衡状态时,n(SO3)=3.6mol
(3)若起始时加入1.2mol SO2、0.6molO2和xmolSO3,达到平衡状态时,各气体的体积分数与上述平衡状态相同,x的取值范围为任意值
(4)若反应开始时V(逆)>V(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是3.6<n(SO3)≤4.
分析 (1)恒温恒压下,通入少量O2能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
(2)依据化学平衡三段式列式计算,设生成三氧化硫物质的量为2x,根据平衡时混合气体总物质的量为2.4mol列式计算得到三氧化硫物质的量;
(3)等压容器中,若起始时a=1.2mol,b=0.6mol,a:b=2:1,等于起始时加入的2mol SO2和1mol O2的量的比值,二者建立的平衡一定为等效平衡;
(4)若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c应大于原平衡时三氧化硫物质的量,若二氧化硫、氧气为0时,可以确定c的最大值.
解答 解:(1)在达到平衡状态A的容器中再通入少量O2,瞬间增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,导致体系中SO2的体积分数减小,若要使SO2的体积分数再变至与原平衡状态A相同,可通入适量SO2,或给体系升温使平衡逆向移动;
故答案为:减小;通入适量SO2;给体系升温;
(2)设反应达到平衡时生成三氧化硫物质的量为2x,
2SO2(g)+O2(g)?2SO3(g),△H<0
起始(mol) 4 2 0
变化(mol) 2x x 2x
平衡(mol) 4-2x 2-x 2x
则:(4-2x)+(2-x)+2x=4.2,
解得:x=1.8mol,即在该平衡状态时n(SO3)=3.6 mol,
故答案为:3.6mol;
(3)等压容器中,若起始时1.2mol SO2、0.6mol O2和x mol SO3,二氧化硫和氧气的物质的量之比是2:1,等于起始时加入的:4mol SO2和2mol O2的量的比值,反应2SO2(g)+O2(g)?2SO3(g)△H<0产物只有三氧化硫,无论三氧化硫的量为多少,利用一边倒的方法,转化为二氧化硫和氧气的量之比均为2:1,二者建立的平衡一定为等效平衡,故达到平衡后各气体的体积分数与平衡状态A相同,
故答案为:任意值;
(4)若原平衡状态A是在恒温恒容下达到的,达到的平衡状态与A相同,按化学计量数完全转化到左边满足n(SO2)=4mol、n(O2)=2mol,要使反应开始时向逆方向进行,则c>3.6,SO2和O2的量均为0,c有值最大时,4molSO2、2molO2完全转化可以得到4molSO3,则起始时n(SO3)的取值范围是:3.6<n(SO3)≤4,
故答案为:3.6<n(SO3)≤4.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的化学计算能力.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. | 1 | B. | 1-a | C. | 2-lg a | D. | 3-lg a |
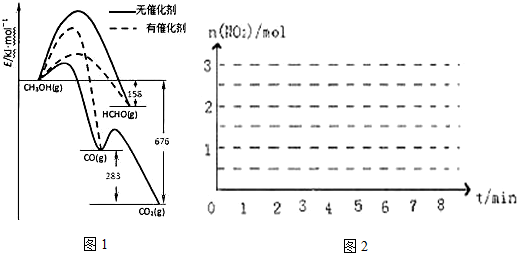
①写出1mol HCHO与O2反应主要生成CO和H2O(g)的热化学方程式:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235kJ•mol-1.
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能.
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于容积固定的容器中发生反应2N2H4(g)+2NO2(g)?3N2(g)+4H2O(Ⅰ)△H<0,下列能说明反应达到平衡状态的是AD.
A.混合气体密度保持不变B.2vg正(NO2)=2v正(N2)
C.N2H4与NO2体积比保持不变D.体系压强保持不变
②在某温度下,10L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
| 物质的量/mol 时间 | n(N2H4) | N(NO2) | N(N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
该温度下反应的平衡常数K8.4.
ii.关于上述反应,下列叙述不正确的是A.
A.达到平衡时,移走部分N2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(N2H2)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入He,则此时v(逆)>v(正)
iii.请画出该反应中n(NO2)随时间变化曲线并画出在第7min时分别升温、加压的情况下n(NO2)随时间变化示意图(在图2上注明变化的条件).
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
| A. | 摩尔质量为44g | B. | 质量为88g/mol | ||
| C. | 有4mol氧原子 | D. | 分子数为6.02×1023 |
实验I:反应产物的定性探究--按如图装置(固定装置已略)进行实验:
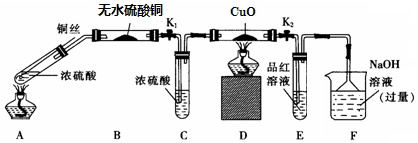
(1)F装置的烧杯中发生反应的离子方程式是SO2+2OH-=SO32-+H2O;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E装置中溶液褪色
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是拉起铜丝,关闭K1,K2
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,若溶液变蓝,证明含有Cu2+;
,若溶液变蓝,证明含有Cu2+
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S.产生Cu2S的反应为
aCu+bH2SO4$\frac{\underline{\;\;△\;\;}}{\;}$cCu2S+dCuSO4+e H2O,则a:b=5:4
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料.
资料1:
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度≥15mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失.

 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料. A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系.
A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子叙述按B、D、C、A、E的顺序依次增大,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、.C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合物可得丁,戊、己、庚均为化合物.已知乙、丙每个分子中均含有10个电子,图为相互转化关系. .
.