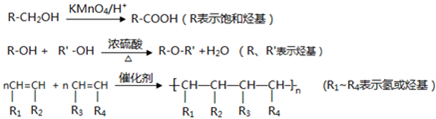
题目内容
有A、B、C、D、E、F六种短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D与A同主族;E与F的原子序数之和为30;丙是离子化合物.
回答下列问题:
(1)写出元素符号:A、 ,B、 ,C、 ,D、 ,E、 ,F、
(2)F元素在周期表中的位置是 ,属于 区元素.
(3)E离子的轨道表示式是
(4)乙的结构简式是 ,其中B原子的杂化方式是 .
(5)丙的电子式是 .
(6)A、C元素还可以形成另一种常见液态化合物A2C,其沸点高于其它同主族元素氢化物的原因是 .
(7)丁分子在气态时常形成E2F6的双聚分子,其分子中各原子均满足8e-稳定结构,写出E2F6的结构式:
.
(8)戊分子的空间构型为 ,属于 分子(填“极性”或“非极性”).
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元素的原子个数比 | A:C=1:1 | B:A=1:2 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
回答下列问题:
(1)写出元素符号:A、
(2)F元素在周期表中的位置是
(3)E离子的轨道表示式是
(4)乙的结构简式是
(5)丙的电子式是
(6)A、C元素还可以形成另一种常见液态化合物A2C,其沸点高于其它同主族元素氢化物的原因是
(7)丁分子在气态时常形成E2F6的双聚分子,其分子中各原子均满足8e-稳定结构,写出E2F6的结构式:
(8)戊分子的空间构型为
考点:位置结构性质的相互关系应用
专题:
分析:有A、B、C、D、E、F六种短周期元素,其原子序数依次增大,B原子最外层电子数比其次外层电子数多2个,次外层为2,最外层为4,共6个电子,则B为C元素;
A,B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且A的原子序数小于碳,所以A为H元素;
C原子的最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6,共8个电子,则C为O元素;
D、E、F同周期,则为第三周期元素,D与A同主族,D的原子序数大于O,则D为Na元素;
形成的化合物E:F=1:3,若E为+3价,则F为-1价,则分别为Al、Cl,二者的原子序数之和为30,符合题意;若E为+6价,则F为-2价,二者均为第VIA族元素,但是二者同周期,所以不符合题意;所以E为Al,F为Cl,据此答题.
A,B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且A的原子序数小于碳,所以A为H元素;
C原子的最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6,共8个电子,则C为O元素;
D、E、F同周期,则为第三周期元素,D与A同主族,D的原子序数大于O,则D为Na元素;
形成的化合物E:F=1:3,若E为+3价,则F为-1价,则分别为Al、Cl,二者的原子序数之和为30,符合题意;若E为+6价,则F为-2价,二者均为第VIA族元素,但是二者同周期,所以不符合题意;所以E为Al,F为Cl,据此答题.
解答:
解:有A、B、C、D、E、F六种短周期元素,其原子序数依次增大,B原子最外层电子数比其次外层电子数多2个,次外层为2,最外层为4,共6个电子,则B为C元素;
A,B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且A的原子序数小于碳,所以A为H元素;
C原子的最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6,共8个电子,则C为O元素;
D、E、F同周期,则为第三周期元素,D与A同主族,D的原子序数大于O,则D为Na元素;
形成的化合物E:F=1:3,若E为+3价,则F为-1价,则分别为Al、Cl,二者的原子序数之和为30,符合题意;若E为+6价,则F为-2价,二者均为第VIA族元素,但是二者同周期,所以不符合题意;所以E为Al,F为Cl,
所以甲为双氧水,乙为乙烯,丙为过氧化钠,丁为三氯化铝,戊为四氯化碳,
(1)由以上分析可知,A为H、B为C、C为O、D为Na、E为Al、F为Cl;
故答案为:H、C、O、Na、Al、Cl;
(2)F为Cl元素,位于第三周期、第VIIA族;Cl元素属于p区元素;
故答案为:第三周期、第VIIA族;p;
(3)Al3+核外有10个电子,其轨道排布式为 ;故答案为:
;故答案为: ;
;
(4)化合物乙是乙烯其结构简式为CH2=CH2;CH2=CH2中C原子含有3个价层电子对,属于sp2杂化;
故答案为:CH2=CH2;sp2;
(5)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
(6)A、C元素还可以形成另一种常见液态化合物A2C,即H2O,水分子间存在氢键,氢键的作用力大于范德华力,所以水的沸点高于其它同主族元素氢化物;
故答案为:分子间存在氢键;
(7)丁分子在气态时常形成E2F6的双聚分子,Al2Cl6分子中各原子均满足8e-稳定结构,则Al2Cl6结构式为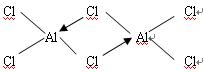 ;
;
故答案为: ;
;
(8)戊为四氯化碳,四氯化碳分子的空间结构与甲烷相同为正四面体,分子的结构对称,分子中正负电荷重合,属于非极性分子;
故答案为:正四面体;非极性.
A,B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且A的原子序数小于碳,所以A为H元素;
C原子的最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6,共8个电子,则C为O元素;
D、E、F同周期,则为第三周期元素,D与A同主族,D的原子序数大于O,则D为Na元素;
形成的化合物E:F=1:3,若E为+3价,则F为-1价,则分别为Al、Cl,二者的原子序数之和为30,符合题意;若E为+6价,则F为-2价,二者均为第VIA族元素,但是二者同周期,所以不符合题意;所以E为Al,F为Cl,
所以甲为双氧水,乙为乙烯,丙为过氧化钠,丁为三氯化铝,戊为四氯化碳,
(1)由以上分析可知,A为H、B为C、C为O、D为Na、E为Al、F为Cl;
故答案为:H、C、O、Na、Al、Cl;
(2)F为Cl元素,位于第三周期、第VIIA族;Cl元素属于p区元素;
故答案为:第三周期、第VIIA族;p;
(3)Al3+核外有10个电子,其轨道排布式为
 ;故答案为:
;故答案为: ;
;(4)化合物乙是乙烯其结构简式为CH2=CH2;CH2=CH2中C原子含有3个价层电子对,属于sp2杂化;
故答案为:CH2=CH2;sp2;
(5)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
 ,
,故答案为:
 ;
;(6)A、C元素还可以形成另一种常见液态化合物A2C,即H2O,水分子间存在氢键,氢键的作用力大于范德华力,所以水的沸点高于其它同主族元素氢化物;
故答案为:分子间存在氢键;
(7)丁分子在气态时常形成E2F6的双聚分子,Al2Cl6分子中各原子均满足8e-稳定结构,则Al2Cl6结构式为
 ;
;故答案为:
 ;
;(8)戊为四氯化碳,四氯化碳分子的空间结构与甲烷相同为正四面体,分子的结构对称,分子中正负电荷重合,属于非极性分子;
故答案为:正四面体;非极性.
点评:本题主要考查了位置结构性质的相互关系的应用,题目涉及元素的推断、电子排布图、杂化类型的判断、电子式、氢键等,侧重于基础知识的综合应用的考查,题目难度中等,元素推断是解题的关键,答题时注意灵活运用元素化合物知识推断元素种类.

练习册系列答案
相关题目
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ?mol-1mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |
下列物质中,既能与盐酸反应,又能跟NaOH溶液反应的是( )
①NaHCO3②Al ③Al2O3④Al(OH)3⑤NaAlO2.
①NaHCO3②Al ③Al2O3④Al(OH)3⑤NaAlO2.
| A、全部 | B、②③⑤ |
| C、①③⑤ | D、①②③④ |
下列反应中,能够说明烯烃分子具有不饱和结构的是( )
| A、燃烧 | B、取代反应 |
| C、加成反应 | D、氧化反应 |