题目内容
在下表中,欲用一种试剂Z来检验盐溶液中的离子X,在同时有离子Y存在时,此检验仍可以判别的是( )
| 试剂Z | 离子X | 离子Y |
| A.NH3.H2O B.AgNO3 C.Na2SO4 D.Ba(NO3)2 | Al3+ Cl- Ba2+ SO42- | Mg2+ CO32- Mg2+ Cl- |
| A、A | B、B | C、C | D、D |
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:A、两种金属离子加氨水均生成白色沉淀;
B、两种阴离子加硝酸银均生成白色沉淀;
C、只有钡离子与硫酸钠反应生成硫酸钡白色沉淀;
D、只有硫酸根与硝酸钡生成白色沉淀.
B、两种阴离子加硝酸银均生成白色沉淀;
C、只有钡离子与硫酸钠反应生成硫酸钡白色沉淀;
D、只有硫酸根与硝酸钡生成白色沉淀.
解答:
解:A、两种金属离子加氨水均生成白色沉淀,不能检验Mg2+的存在,应选NaOH,故A错误;
B、两种阴离子加硝酸银均生成白色沉淀,不能检验Cl-的存在,应先加硝酸后加硝酸银,故B错误;
C、只有钡离子与硫酸钠反应生成硫酸钡白色沉淀,Mg2+不反应,则可检验Ba2+的存在,故C正确;
D、只有硫酸根与硝酸钡生成白色沉淀,能检验SO42-的存在,故D正确;
故选CD.
B、两种阴离子加硝酸银均生成白色沉淀,不能检验Cl-的存在,应先加硝酸后加硝酸银,故B错误;
C、只有钡离子与硫酸钠反应生成硫酸钡白色沉淀,Mg2+不反应,则可检验Ba2+的存在,故C正确;
D、只有硫酸根与硝酸钡生成白色沉淀,能检验SO42-的存在,故D正确;
故选CD.
点评:本题考查物质的检验及鉴别,为高频考点,侧重元素化合物性质的考查,把握离子之间的反应及反应现象、常见离子的检验等为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
关于Fe(OH)2 的制备能够成功的是( )
| A、向FeCl2 溶液中逐滴加入NaOH溶液 |
| B、向FeSO4溶液中逐滴加入氨水 |
| C、先将盛有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2的白色沉淀 |
| D、取新配制的FeSO4溶液适量放入试管中,在加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液 |
关于小苏打水溶液的表述正确的是( )
| A、c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、HCO3-的电离程度大于HCO3-水解程度 |
| D、存在的电离有NaHCO3=Na++HCO3-,HCO3-?CO32-+H+,H2O?H++OH- |
在实验室里,要想得到白色胶状物质氢氧化铝,常常用铝盐溶液与下列试剂中的反应制取.( )
| A、石灰水 | B、氢氧化钠溶液 |
| C、硫酸 | D、氨水 |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A、Na+ K+ OH- Cl- |
| B、Na+ Cu2+ SO42- NO3- |
| C、Mg2+ Na+ SO42- Cl- |
| D、Ba2+ HCO3- NO3- K+ |
在实验室中,下列试剂中需要保存在棕色试剂瓶的是( )
| A、浓硫酸 | B、盐酸 |
| C、氢氧化钠溶液 | D、硝酸银溶液 |
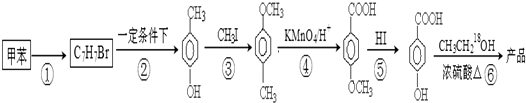
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
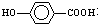
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)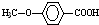 的同分异构体很多,其中符合下列条件有
的同分异构体很多,其中符合下列条件有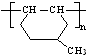 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选) 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知: