题目内容
13.实验室采用如图所示的装置,可将反应粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).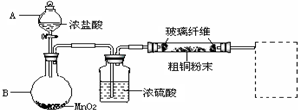
(1)仪器A的名称是分液漏斗.
(2)连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性.
(3)装置B中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)否.
(5)虚线内缺少实验装置,请你画出装置图,标明药品名称.
分析 (1)依据仪器的形状说出其名称;
(2)气体制备和性质检验实验都需要先检验装置的气密性;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(4)氯化氢气体和铜不反应,不影响氯气和铜发生的反应;
(5)氯气有毒,不能直接排放,过量的氯气应进行尾气处理;
解答 解:(1)依据仪器的形状可知A为分液漏斗;
故答案为:分液漏斗;
(2)该实验为氯气的制备和性质的检验,所以连接好仪器后首先应检查装置的气密性;
故答案为:检验装置气密性;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(4)氯化氢气体和铜不反应,不影响氯气和铜发生的反应,没有必要增加吸收HCl的装置,
故答案为:否;
(5)氯气有毒,不能直接排放,过量的氯气应进行尾气处理,氯气能与氢氧钠溶液反应,可用盛有氢氧化钠溶液的洗气瓶或者烧杯吸收过量的氯气,装置图为: ;
;
故答案为: .
.
点评 本题考查了氯气的制备和性质的检验,明确氯气制备原理及氯气化学性质是解题关键,题目难度不大.

练习册系列答案
相关题目
7.常温下,下列各组微粒在指定溶液中可能大量共存的是( )
| A. | 0.1 mol/L FeCl3溶液:K+、Br-、H2O2 | |
| B. | 含大量NO3-的溶液:Fe2+、SO42-、H+ | |
| C. | 水电离产生的c(OH-)=10-13mol/L的溶液:Al3+、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:NH4+、CrO42-、ClO- |
5.测定胆矾结晶水含量的操作中,正确的是( )
| A. | 加热晶体时先用小火,后渐改为用大火加热至晶体变白 | |
| B. | 灼烧时如有晶体溅出容器,应再加一些晶体继续加热 | |
| C. | 加热后的冷却放在干燥器中进行 | |
| D. | 加热、冷却、称量,重复多次即是恒重操作 |
3.用”>”、”<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |

 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.