题目内容
1.为了探究氯水的漂白性,某化学兴趣小组从A、B、C、D中选用仪器制备干燥、纯净的氯气,并设计了如图实验: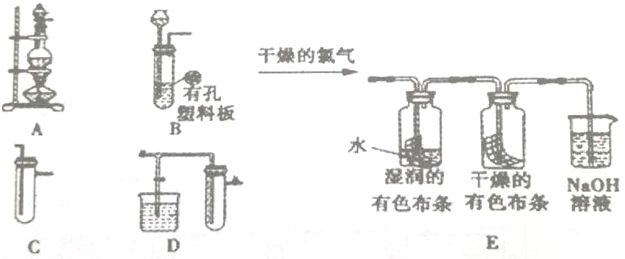
(1)请写出实验室制取Cl2的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)不考虑收集气体,若气流从左向右制备干燥、纯净的氯气时仪器连接顺序为ACC(填写字母,仪器可以重复使用).
(3)将干燥的氯气通入后,E图集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此认为HClO(填化学式)具有漂白性.甲同学认为兴趣小组的设计存在缺陷,应该做如下修改:先通过干燥的有色布条,再通过湿润的有色布条
(4)E的烧杯中NaOH溶液所起的作用是吸收过量的氯气,烧杯中所发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
(5)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时5min,小烧杯中盛2mol.L-1NaOH溶液的体积至少应为250mL.
分析 (1)实验室用加热二氧化锰与浓盐酸的方法制取氯气;
(2)浓盐酸具有挥发性,制取的氯气中含有氯化氢和水蒸气,分别用饱和食盐水、浓硫酸除杂;根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(3)氯气能够与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;
(4)氯气有毒,不能直接排放到空气中,氯气能够与碱反应,应选择碱性溶液吸收过量的氯气;
(5)根据化学方程式Cl2+2NaOH=NaCl+NaClO+H2O进行计算.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,制取的氯气中含有氯化氢和水蒸气,分别用饱和食盐水洗气瓶(C)、浓硫酸洗气瓶(C)除杂,所以正确的顺序为:ACC;
故答案为:ACC;
(3)将干燥的氯气通入后,E图集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有很快褪色,由此认为 HClO具有漂白性;为使实验更严密,应先通入干燥的有色布条,再通过湿润的有色布条;
故答案为:HClO;先通过干燥的有色布条,再通过湿润的有色布条;
(4)氯气有毒,不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收氯气,氯气与氢氧化钠反应生成氯化钠和次氯酸钠、水,方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收过量的氯气;Cl2+2NaOH=NaCl+NaClO+H2O;
(5)5分钟时n(Cl2)=$\frac{1.12L×5}{22.4L/mol}$=0.25mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.5mol,
所以V(NaOH)=$\frac{0.5mol}{2mol/L}$=0.25L=250mL,
故答案为:250.
点评 本题考查氯气的实验室制备及HClO的漂白性的探究,题目难度不大,明确氯气制备原理及性质是解题关键,注意氯气与次氯酸性质的差异性,注意相关反应化学方程式或者离子方程式的书写.

甲用pH试纸测出0.10mol/L的醋酸溶液pH=4;
乙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小
丙将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的pH变化大
丁取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,测量醋酸放出H2的速率快
上述实验可以实现并能证明醋酸是弱酸的是( )
| A. | 一位同学 | B. | 二位同学 | C. | 三位同学 | D. | 四位同学 |
| A. | 氯化钠的电子式为Na:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| B. | 次氯酸的电子式H:$\underset{\stackrel{•}{C}}{•}\underset{\stackrel{•}{l}}{•}$: | |
| C. | 二氧化碳的结构式为O=C=O | |
| D. | NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
| A. | 第一电离能:N>O | B. | 第一电子亲和能:F<Cl | ||
| C. | 电负性:O<Cl | D. | 共价键的键角:NH3<H2S |
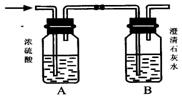 某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
某混合气体X含H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
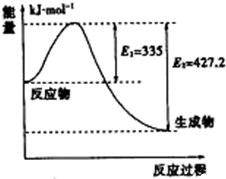 由化学能转变的热能或电能是人类使用的最主要的能源.
由化学能转变的热能或电能是人类使用的最主要的能源.