题目内容
3.一种阳光驱动的二氧化碳捕获装置如图所示,下列说法正确的是( )
| A. | 该装置的能量转化方式为太阳能转化为电能 | |
| B. | 工作时,阳极附近pH减小 | |
| C. | 电路中每转移4mol电子,捕获44g二氧化碳 | |
| D. | 阴极的电极反应为CO2+2e-=CO+O2- |
分析 A.装置中光能转化为电能、电能转化为化学能;
B.阳极上水失去电子生成氧气和氢离子;
C.阴极上CO2+2e-+2H+=CO+H2O,根据电子与二氧化碳的关系计算;
D.阴极上二氧化碳得电子生成CO和水.
解答 解:A.装置中光能转化为电能,在电解时电能又转化为化学能,故A错误;
B.阳极上水失去电子生成氧气和氢离子,所以氢离子浓度增大,则阳极附近pH减小,故B正确;
C.阴极上CO2+2e-+2H+=CO+H2O,电路中每转移4mol电子,捕获二氧化碳为2mol,即88g,故C错误;
D.阴极上二氧化碳得电子生成CO和水,则阴极的电极反应为CO2+2e-+2H+=CO+H2O,故D错误.
故选B.
点评 本题考查了电解池原理,题目难度中等,正确判断书写阴阳极的反应式为解答关键,注意熟练掌握电解池的工作原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.在绝热密闭容器中发生反应:aM(g)+bN(g)?cW(g) 达平衡后,测得M气体的浓度为0.5mol/L.若将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )
| A. | 反应速率增大 | B. | 平衡向右移动 | C. | 体系温度升高 | D. | W的质量分数降低 |
14.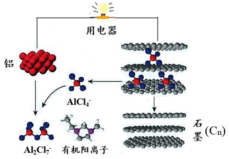 近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
 近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
近期,科学家成功研制出一种可在一分钟内完成充放电的超常性能铝离子电池.该电池内部的A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 放电时,铝为负极、石墨为正极 | |
| B. | 充电时,A1Cl4-向石墨电极移动 | |
| C. | 放电时,负极的电极反应式为A1十7A1Cl4--3e-=4 A12Cl7- | |
| D. | 充电时,电子从石墨电极直接经导线流入铝电极,然后再经电解质溶液流回石墨电极 |
11.氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO合成.下列叙述正确的是( )
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成2 mol AlN需转移6 mol电子 | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | AlN的摩尔质量为41 g |
18.下列有关物质性质与应用的说法都正确,且性质能解释应用的是( )
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
8.下列物质分别在氯气中燃烧,能产生白烟现象的是( )
| A. | Na | B. | H2 | C. | Fe | D. | Cu |
12.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
13.下列有关实验的操作正确的是( )
| 实验 | 操作 | |
| A | 除去NaHCO3固体中混有的NH4Cl | 直接将固体加热 |
| B | 实验室收集Cu与稀硝酸反应成的NO | 向上排空气法收集 |
| C | 检验乙酸具有酸性 | 配制乙酸溶液,滴加NaHCO3溶液有气泡产生 |
| D | 测定某稀硫酸的浓度 | 取20.00ml该稀硫酸于干净的锥形瓶中,用 0.1000mol/L的NaOH标准液进行滴定 |
| A. | A | B. | B | C. | C | D. | D |
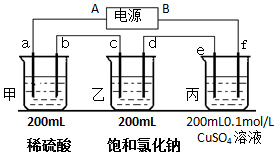 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则