题目内容
7.12.8g Cu与过量的9mol/L 100mL HNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中c(H+)=3mol/L,则反应后溶液中所含NO3-的物质的量( )| A. | 0.3mol | B. | 0.5mol | C. | 0.7mol | D. | 0.75mol |
分析 n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,反应后溶液存在Cu2+、H+、NO3-根据溶液呈电中性原则计算溶液中所含n(NO3-).
解答 解:n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,反应后溶液存在Cu2+、H+、NO3-,
其中n(Cu2+)=0.2mol,n(H+)=3×0.1=0.3mol,
根据溶液呈电中性原则,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),
则n(NO3-)=2×0.2mol+0.3mol=0.7mol,故选C.
点评 本题考查氧化还原反应的计算,题目难度不大,本题从溶液电中性的角度解答较为简单,也可根据N元素守恒计算.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
17.某一有机物A可发生下列反应: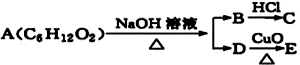 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15.进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )
| A. | 将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体 | |
| B. | 在AgNO3溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强 | |
| C. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中一定不含K+ | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有脱水性 |
2.第ⅢA族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素(且m≠n),且B在A的上一周期,当A的原子序数为x时,B的原子序数可能为( )
| A. | x-n | B. | x+m | C. | x-m | D. | x+n |
12.下列各组物质中,属于同分异构体的是( )
| A. | 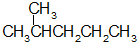 和 和 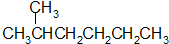 | |
| B. | H2N-CH2-COOH 和 H3C-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH | |
| D. | H3C-CH2-O-CH2-CH3和 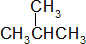 |
16.R、W、X、Y、Z为原子序数递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
| A. | 若R(OH)n为强碱,W(OH)n+1也为强碱 | |
| B. | 若HnXO${\;}_{{m}_{\;}}$为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
17.下列各物质只用水不能将其鉴别出来的是( )
| A. | CuSO4、Na2SO4、BaSO4三种粉末 | B. | CuSO4、(NH4)2SO4、Na2SO4三种粉末 | ||
| C. | 汽油、乙醇、四氯化碳三种液体 | D. | NaOH、NH4NO3、NaCl三种晶体. |
 按要求填空.
按要求填空. .
.