题目内容
10.按要求填空:(1)写出下列物质的电子式:KCl
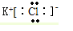 N2
N2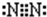 Na2O2
Na2O2 Mg3N2
Mg3N2
(2)用电子式表示下列物质的形成过程:CO2
 .
.
分析 (1)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
(2)二氧化碳为共价化合物,碳原子与两个氧原子分别共用2对电子.
解答 解:(1)KCl为离子化合物,由钾离子与氯离子构成,电子式为: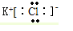 ;
;
氮气分子中两个N原子形成三对共用电子对,氮气分子的电子式为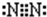 ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
Mg3N2是离子化合物,由Mg2+离子和N3-离子构成,Mg3N2的电子式为 ;
;
故答案为: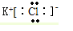 ;
;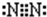 ;
; ;
;
(2)二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: ,
,
故答案为: .
.
点评 本题考查电子式的书写和用电子式表示形成过程,难度不大,掌握电子式的书写规则是关键,注意未成键的孤对电子对容易忽略.

练习册系列答案
相关题目
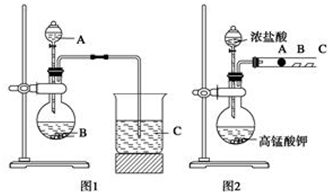
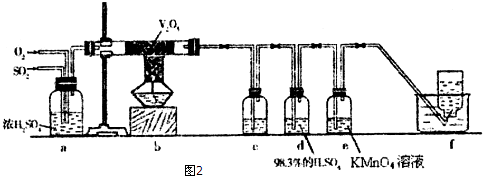
13.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
实验流程如下:

已知K2MnO4溶液显绿色,KMnO4溶液紫红色.请回答下列问题:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.醋酸 C.盐酸 D.硫酸
(3)下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(5)烘干时,温度控制在80℃为宜,温度不宜过高的理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(6)通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①滴定过程溶液中发生的离子反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶、胶头滴管.
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将偏小.
④滴定终点溶液的颜色变化是溶液由红色变无色.
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为$\frac{CVM}{250W}$×100%(高锰酸钾摩尔质量用M表示).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |

已知K2MnO4溶液显绿色,KMnO4溶液紫红色.请回答下列问题:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.醋酸 C.盐酸 D.硫酸
(3)下列监控K2MnO4歧化完全的方法或操作可行的是B.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(4)当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(5)烘干时,温度控制在80℃为宜,温度不宜过高的理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(6)通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①滴定过程溶液中发生的离子反应为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶、胶头滴管.
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将偏小.
④滴定终点溶液的颜色变化是溶液由红色变无色.
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为$\frac{CVM}{250W}$×100%(高锰酸钾摩尔质量用M表示).
15.下列说法不正确的是( )
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
19.下列装置是在制备氨气过程中所用到的装置,正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |

 )分子的一氯代物有2种.
)分子的一氯代物有2种. 和
和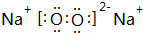 ;
; ;
;