题目内容
19.下列装置是在制备氨气过程中所用到的装置,正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.氯化铵受热分解生成氯化氢气体和氨气,在试管口处又重新反应生成氯化铵固体;
B.氨气是极易溶于水的气体,倒扣漏斗浸入水中会和导管一样引起倒吸;
C.分液漏斗中加入浓氨水,滴入氧化钙固体,氧化钙和水反应放热生成氢氧化钙,使一水合氨分解生成氨气;
D.氨气极易溶于水收集时易和空气中水蒸气形成对流,不能收集到纯净的气体;
解答 解:A.氯化铵受热分解生成氯化氢气体和氨气,NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑,在试管口处又重新反应生成氯化铵固体NH3+HCl=NH4Cl,不能制备氨气,故A错误;
B.氨气是极易溶于水的气体,倒扣漏斗浸入水中会和导管一样引起倒吸,应把漏斗倒扣在水面上防止倒吸,故B错误;
C.分液漏斗中的浓氨水,滴入氧化钙固体,氧化钙和水反应放热生成氢氧化钙,使一水合氨分解生成氨气,可以制备氨气,故C正确;
D.氨气极易溶于水,收集时易和空气中水蒸气形成对流,不能收集到纯净的气体,应在试管口处添加一团棉花,故D错误;
故选C.
点评 本题考查了实验室中氨气制备和收集的方法分析,注意氨气极易溶于水吸收时防倒吸,收集时防对流,题目较简单.

练习册系列答案
相关题目
7.某实验小组用NaOH标准溶液测定盐酸溶液的物质的量浓度,其部分操作步骤如下:
(1)用酸式滴定管量取25.00mL待测液于锥形瓶中,并滴加几滴酚酞作指示剂.
(2)用0.2500mol•L-1标准NaOH溶液滴定待测盐酸溶液,滴定时左手挤压碱式滴定管的玻璃球,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色(从“滴定管内液面”、“锥形瓶内溶液颜色”中选择填空)的变化,直到滴定终点,滴定终点时锥形瓶内溶液的pH约为8.2,达到终点的具体现象是由无色变为浅红色,且半分钟不变色.
(3)若两次实验滴定的数据如表:
根据表数据,计算出的待测盐酸溶液的物质的量浓度是0.20mol•L-1.
(4)问题讨论:若碱式滴定管下端尖嘴中有气泡存在,除去的方法是弯曲乳胶管,让尖嘴略朝上,挤捏乳胶管.
(5)误差分析:若其它操作均正确,出现下列情形时,可能导致测定结果有偏差.
①滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将偏高(填偏高、偏低或无影响,下同).
②读数时,滴定前仰视,滴定毕俯视,测定结果将偏低.
(1)用酸式滴定管量取25.00mL待测液于锥形瓶中,并滴加几滴酚酞作指示剂.
(2)用0.2500mol•L-1标准NaOH溶液滴定待测盐酸溶液,滴定时左手挤压碱式滴定管的玻璃球,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色(从“滴定管内液面”、“锥形瓶内溶液颜色”中选择填空)的变化,直到滴定终点,滴定终点时锥形瓶内溶液的pH约为8.2,达到终点的具体现象是由无色变为浅红色,且半分钟不变色.
(3)若两次实验滴定的数据如表:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
(4)问题讨论:若碱式滴定管下端尖嘴中有气泡存在,除去的方法是弯曲乳胶管,让尖嘴略朝上,挤捏乳胶管.
(5)误差分析:若其它操作均正确,出现下列情形时,可能导致测定结果有偏差.
①滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将偏高(填偏高、偏低或无影响,下同).
②读数时,滴定前仰视,滴定毕俯视,测定结果将偏低.
11.下列反应属于吸热反应的是( )
| A. | C6H12O6(葡萄糖)+6O2═6CO2+6H2O | B. | CH3COOH+KOH═CH3COOK+H2O | ||
| C. | 所有高温条件下发生的反应 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |

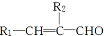 +H2O
+H2O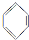 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$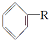 +HCl
+HCl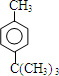 ;
;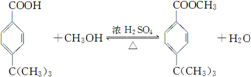 ;
;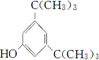 .
. .
.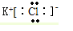 N2
N2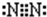 Na2O2
Na2O2 Mg3N2
Mg3N2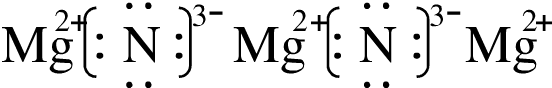
 .
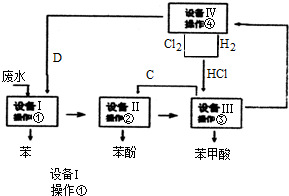
.
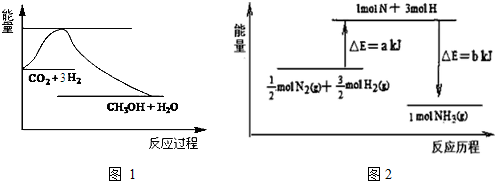
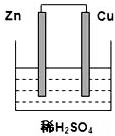 根据如图所示的装置,完成下列各空.
根据如图所示的装置,完成下列各空.