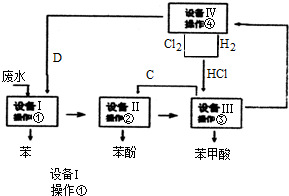
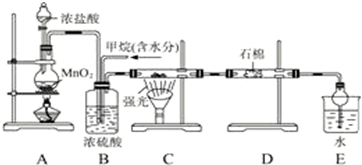
题目内容
15.下列说法不正确的是( )| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
分析 A、0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后生成CH3COONa,加少量的CH3COONa固体则,水解程度减小;
B、反应能否自发进行由△G=△H-T△S决定,△G<0反应自发进行,△G>0反应不能自发进行.据此判断;
C、1mol维生素P中含有4mol酚羟基,故能与4molNaOH发生中和反应生成酚钠,能与氢气发生加成反应的苯环,C=C和C=O,则与氢气加成所需的氢气的物质的量为8mol;
D、根据红外光谱图可以判断分子中的官能团.
解答 解:A、0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后生成CH3COONa,加少量的CH3COONa固体则,水解程度减小,所以则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大,故A正确;
B、反应C(s)+CO2(g)=2CO(g)是熵增过程,即△S>0,常温下,反应不能自发进行,则△H-T△S>0,由于△S>0,所以△H>0,故B正确;
C、1mol维生素P中含有4mol酚羟基,故能与4molNaOH发生中和反应生成酚钠,能与氢气发生加成反应的苯环,C=C和C=O,则与氢气加成所需的氢气的物质的量为8mol,故C正确;
D、根据红外光谱图可以判断分子中的官能团,乙醇和乙醚中的官能团不同,所以红外光谱分析能区分乙醇和乙醚,故D错误;
故选D.
点评 本题考查盐的水解平衡的移动、反应的自发性和有机物的结构和性质,题目难度中等,C选项要注意判断有机物的官能团的数目和种类,学生还要清楚红外光谱图可以判断分子中的官能团的种类.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,X与Y的原子序数之和为Z与W原子序数之和的$\frac{2}{3}$.下列说法正确的是( )
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
20.一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)
完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是Al3+;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为正四面体.
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态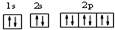 .
.
(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为1:2;NaAlSi3O8改写成氧化物形式是Na2O•Al2O3•6SiO2.
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
分析数据可以得出,氯化钠熔浸钾长石是吸热反应(填“放热”或“吸热”);在950℃时,欲提高熔出钾的速率可以采取的一种措施是充分搅拌,将钾长石粉碎成更小的颗粒.
(5)Na(l)+KCl(l)?NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是根据勒夏特列原理,将钾蒸气分离出来(降低了产物的浓度),化学平衡向正反应方向移动.
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷.例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为4Al+3TiO2+3C $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC.
完成下列填空:
(1)上述反应涉及的第三周期元素中,离子半径最小的是Al3+;Cl原子与Si原子可构成有5个原子核的分子,其分子的空间构型为正四面体.
(2)用最详尽描述核外电子运动状态的方式,表示氧离子核外电子的运动状态
 .
.(3)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为1:2;NaAlSi3O8改写成氧化物形式是Na2O•Al2O3•6SiO2.
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量分数)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
(5)Na(l)+KCl(l)?NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法可行的原因是根据勒夏特列原理,将钾蒸气分离出来(降低了产物的浓度),化学平衡向正反应方向移动.
(6)铝可用于冶炼难熔金属,利用铝的亲氧性,还可用于制取耐高温的金属陶瓷.例如将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面上,然后在高温下煅烧,可在金属表面形成耐高温的涂层TiC,该反应的化学方程式为4Al+3TiO2+3C $\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC.
7.某实验小组用NaOH标准溶液测定盐酸溶液的物质的量浓度,其部分操作步骤如下:
(1)用酸式滴定管量取25.00mL待测液于锥形瓶中,并滴加几滴酚酞作指示剂.
(2)用0.2500mol•L-1标准NaOH溶液滴定待测盐酸溶液,滴定时左手挤压碱式滴定管的玻璃球,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色(从“滴定管内液面”、“锥形瓶内溶液颜色”中选择填空)的变化,直到滴定终点,滴定终点时锥形瓶内溶液的pH约为8.2,达到终点的具体现象是由无色变为浅红色,且半分钟不变色.
(3)若两次实验滴定的数据如表:
根据表数据,计算出的待测盐酸溶液的物质的量浓度是0.20mol•L-1.
(4)问题讨论:若碱式滴定管下端尖嘴中有气泡存在,除去的方法是弯曲乳胶管,让尖嘴略朝上,挤捏乳胶管.
(5)误差分析:若其它操作均正确,出现下列情形时,可能导致测定结果有偏差.
①滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将偏高(填偏高、偏低或无影响,下同).
②读数时,滴定前仰视,滴定毕俯视,测定结果将偏低.
(1)用酸式滴定管量取25.00mL待测液于锥形瓶中,并滴加几滴酚酞作指示剂.
(2)用0.2500mol•L-1标准NaOH溶液滴定待测盐酸溶液,滴定时左手挤压碱式滴定管的玻璃球,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色(从“滴定管内液面”、“锥形瓶内溶液颜色”中选择填空)的变化,直到滴定终点,滴定终点时锥形瓶内溶液的pH约为8.2,达到终点的具体现象是由无色变为浅红色,且半分钟不变色.
(3)若两次实验滴定的数据如表:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
(4)问题讨论:若碱式滴定管下端尖嘴中有气泡存在,除去的方法是弯曲乳胶管,让尖嘴略朝上,挤捏乳胶管.
(5)误差分析:若其它操作均正确,出现下列情形时,可能导致测定结果有偏差.
①滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将偏高(填偏高、偏低或无影响,下同).
②读数时,滴定前仰视,滴定毕俯视,测定结果将偏低.

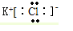 N2
N2 Na2O2
Na2O2 Mg3N2
Mg3N2
 .
.