题目内容
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )| A. | 铜器出现铜绿 | B. | 铁制菜刀生锈 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面生成致密的薄膜 |
分析 生活现象中涉及的化学反应中,若有元素的化合价变化,则反应为氧化还原反应,以此来解答.
解答 解:A、铜器出现铜绿【Cu2(OH)2CO3】,Cu的化合价从0价升高到+2价,存在化合价的变化,涉及氧化还原反应,故A不选;
B、铁氧化变成氧化铁,发生氧化还原反应,故B不选;
C、大理石雕像被酸雨腐蚀毁坏,发生复分解反应,非氧化还原反应,故C选;
D、铝锅表面生成致密的薄膜,铝氧化成氧化铝,是氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中的元素化合价变化为解答的关键,侧重氧化还原反应判断与生活中化学的联系的考查,题目难度不大.

练习册系列答案
相关题目
11.漂粉精可由Cl2通入消石灰中制备,漂粉精的有效成分是( )
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | CaCO3 |
12.下列晶体熔化时所需克服的作用力完全相同的是( )
| A. | 钠与氯化钠 | B. | 干冰与冰 | ||
| C. | 碘与二氧化硅 | D. | 氢氧化钠与冰醋酸 |
9.化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
| A. | 氟利昂(CCl2F2)会破坏大气臭氧层从而导致“温室效应” | |
| B. | 开发高效氢能、太阳能灯新能源汽车,可以减缓城市机动车尾气污染 | |
| C. | PM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
16.60mL含有0.20mol碳酸钠的溶液和20mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 10.0 mol/L | B. | 15 mol/L | C. | 1.2 mol/L | D. | 0.9 mol/L |
6.下列有关物质的性质和该性质的应用均正确的是( )
| A. | SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸 | |
| B. | 氧化铁为红棕色固体,可用于作油漆红色涂料 | |
| C. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| D. | 钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
13.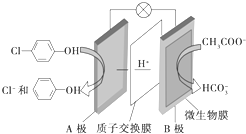 含乙酸钠和对氯酚
含乙酸钠和对氯酚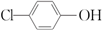 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
 含乙酸钠和对氯酚
含乙酸钠和对氯酚 的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )
的废水可以利用微生物电池处理,其原理如图所示.下列说法中正确的是( )| A. | B极是电池的正极 | |
| B. | H+向A极移动 | |
| C. | B极的电极反应式为CH3COO-+8e-+4H2O═2HCO3-+9H+ | |
| D. | 此电池可以在高温下使用 |
10.下列关于金属冶炼的说法正确的是( )
| A. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 | |
| B. | Cu的湿法冶炼是将金属钠投入到CuSO4溶液中置换出铜 | |
| C. | 炼铁时加入石灰石的目的是除去过量的碳 | |
| D. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
11.下列表示甲基的电子式中,正确的是( )
| A. | 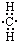 | B. | 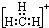 | C. | 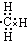 | D. | 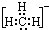 |