题目内容
6.下列有关物质的性质和该性质的应用均正确的是( )| A. | SiO2是酸性氧化物,可制成玻璃容器盛装氢氟酸 | |
| B. | 氧化铁为红棕色固体,可用于作油漆红色涂料 | |
| C. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| D. | 钠具有金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
分析 A、二氧化硅与氢氟酸反应;
B、氧化铁是红棕色固体;
C、次氯酸有强氧化性;
D、钠与硫酸铜溶液反应时先与水发生反应.
解答 解:A、二氧化硅与氢氟酸反应,所以不能用玻璃容器盛装氢氟酸,故A错误;
B、氧化铁是红棕色固体,所以可用于作油漆红色涂料,故B正确;
C、次氯酸有强氧化性,而不是酸性,故C错误;
D、钠与硫酸铜溶液反应时先与水发生反应生成氢氧化钠,氢氧化钠再与硫酸铜溶液反应生成氢氧化铜,故D错误.
故选B.
点评 本题考查二氧化硅的性质、消毒剂、钠与硫酸铜溶液的反应等,难度不大,注意钠与硫酸铜溶液反应时先与水发生反应生成氢氧化钠,氢氧化钠再与硫酸铜溶液反应生成氢氧化铜.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
16.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
17.制取漂白粉的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应的氧化剂与还原剂之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:2 |
14.下列离子方程式正确的是( )
| A. | CaCO3与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | Ba(OH)2与H2SO4反应:H++OH-=H2O | |
| C. | 铁与醋酸反应:Fe+2H+=Fe2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A. | 铜器出现铜绿 | B. | 铁制菜刀生锈 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面生成致密的薄膜 |
11.下列说法中,不正确的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、葡萄糖都是无色溶于水的有机化合物 |
18.下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(2)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是发生氧化反应,溶液的酸性均增强.
(3)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(4)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体1.88g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
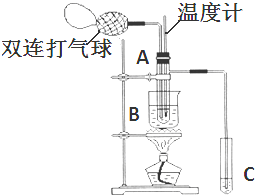
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(2)方案一是否可行否(填“是”或“否”),理由是不论是发生取代反应还是发生氧化反应,溶液的酸性均增强.
(3)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(4)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体1.88g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
16.在NaCl和NaBr的混合溶液中,Na+、Br-、Cl-的物质的量浓度之比不可能出现的是( )
| A. | 5:3:2 | B. | 3:2:2 | C. | 5:4:1 | D. | 3:2:1 |