题目内容
17.过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3,[Fe(H2NCONH2)6](NO3)3等.(1)Fe2+基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 .
(2)与CN-互为等电子体的一种分子是:CO或N2,CN-可在TiO2作光催化剂下转化为OCN-,OCN-中三种元素的电负性由大到小的顺序为O>N>C,尿素(H2NCONH2)分子中C、N原子的杂化方式分别为sp2;sp3,1mol Fe(CN)63-中含有σ键的数目为12×6.02×1023个或12mol.
(3)铁的另一种配合物Fe(CO)X的中心原子价电子数与配体提供电子数之和为18,则X=5,已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)X晶体属于分子晶体(填晶体类型).
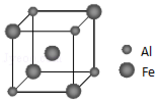
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成.已知小立方体如图所示.则这种晶胞中,离Al原子最近且距离相等的Fe原子有8个,该晶体的密度的计算式为:$\frac{195}{2N{\;}_{A}(a+b){\;}^{3}}$g•cm-3(不用化简,Al原子半径为a cm,Fe原子半径为b cm,阿伏伽德罗常数的值为NA).
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)根据原子个数相等价电子数相等的微粒为等电子体分析;同周期自左而右电负性增大;由尿素的结构式 可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;1molCN-中含有2molπ键,1molσ键;
可知,尿素分子中N原子成3个单键,含有1对孤对电子,杂化轨道数为4,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,据此判断;1molCN-中含有2molπ键,1molσ键;
(3)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
(4)依据离Al原子最近且距离相等的Fe原子在体心,所以离Al原子最近且距离相等的Fe原子有8个;计算一个晶胞的质量m,计算晶胞的体积V,依据ρ=$\frac{m}{V}$计算其密度.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,
故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为CO或N2分子等;
同周期自左而右电负性增大,故OCN-中三种元素的电负性由大到小的顺序为:O>N>C;
由尿素分子的结构式 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,N原子成3个单键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故答案为:sp2;sp3;
在配合物Fe(CN)63-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12×6.02×1023个或12mol,
故答案为:CO或N2;O>N>C;sp2;sp3;12×6.02×1023个或12mol;
(3)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
故答案为:5;分子晶体;
(4)依据离Al原子最近且距离相等的Fe原子在体心,所以离Al原子最近且距离相等的Fe原子有8个;依据铁铝合金晶胞结构铝原子的数目为4×$\frac{1}{8}$=$\frac{1}{2}$;铁原子数目为1+4×$\frac{1}{8}$=$\frac{3}{2}$,则一个小立方体质量为$\frac{27}{2N{\;}_{A}}$ g+$\frac{56×3}{2×N{\;}_{A}}$g=$\frac{195}{2N{\;}_{A}}$g,所以其密度ρ=$\frac{m}{V}$=$\frac{\frac{195}{2N{\;}_{A}}}{(a+b){\;}^{3}}$g•cm-3=$\frac{195}{2N{\;}_{A}(a+b){\;}^{3}}$g•cm-3.
故答案为:8; $\frac{195}{2N{\;}_{A}(a+b){\;}^{3}}$g•cm-3.
点评 本题主要考查了电子排布式、电负性、等电子体、σ键、晶体类型、晶体结构等知识点,内容较多,中等难度,(4)明确晶胞中每个原子被几个晶胞占有是解答关键.

| 选项 | 实验操作和现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者的pH比后者的大 | 元素非金属性:S>C |
| B | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
| C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
| D | 向溶液中滴加盐酸酸化的BaCl2溶液,产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
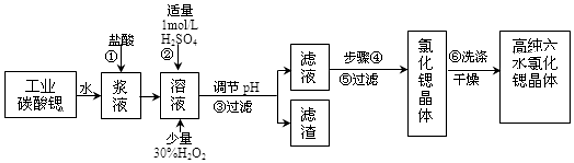
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
请回答:
(1)在步骤②中加入少量的30%H2O2,反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为SrO、SrCO3或Sr(OH)2等.过滤所得滤渣的主要成分是Fe(OH)3和BaSO4 .
(3)关于上述流程中的步骤④、⑤、⑥的说法,正确的是A、B.
A.步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B.可以通过降低结晶速率的方法来得到较大颗粒的SrCl2•6H2O 晶体
C.某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D.步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和SrCl2溶液
(4)工业上采用减压烘干或者用50~60℃的热风吹干SrCl2•6H2O晶体的原因是防止SrCl2•6H2O 晶体在61℃以上时失去结晶水.
(5)为了测定所得SrCl2•6H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.200mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl2•6H2O晶体样品的纯度.用去上述浓度的NH4SCN溶液20.0mL,则原SrCl2•6H2O晶体的纯度为95.3%.
| A. | 欲检验某溶液中含有Fe2+,先向该溶液中加氯水,再加硫氰化钾 | |
| B. | 常温下,铝罐可以用于盛装浓硝酸,利用了浓硝酸的酸性 | |
| C. | Na2O2与水反应可用于制O2,其中Na2O2既做氧化剂又做还原剂 | |
| D. | 可用HF刻蚀玻璃,是因为玻璃中含有的SiO2具有酸性氧化物的通性 |
| A. | 氮气和氢气不再发生反应时的状态 | |
| B. | 体系中的总压强不变时的状态 | |
| C. | 氮气的浓度与氢气的浓度之比为1:3时 | |
| D. | 混合物的密度保持不变时的状态 |
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)同浓度的a.CH3COO-,b.HCO3-,c.CO32-,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(2)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(3)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是b>a>d>c(填编号).
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D. c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
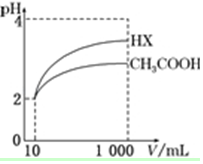
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283 kJ | |
| B. | 两个反应都只发生了共价键的断裂和形成 | |
| C. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 | |
| D. | Na2O2(s)+CO(g)═Na2CO3(s)△H=-509 kJ/mol. |
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw 减小 | |
| B. | 将水加热,Kw增大,pH<7 | |
| C. | 向水中通入少量HCl气体,平衡逆向移动,c(H+ )降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+ )和Kw 均不变 |
 也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程:
也被禁用. 下面是一种以苯为原料合成过氧化苯甲酰的流程: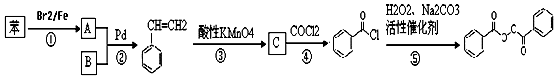
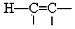 $\stackrel{Pd}{→}$
$\stackrel{Pd}{→}$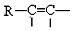
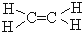 ;
;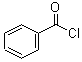 +H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$
+H2O2$\frac{\underline{\;催化剂\;}}{碳酸钠}$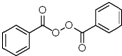 +2HCl;
+2HCl;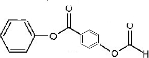 、
、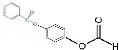 ;
; ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.