题目内容
8.关于海带中提取碘实验,下列说法正确的是( )| A. | 实验中包含溶解、过滤、升华等步骤 | |
| B. | 加入过量的氯水将I-全部氧化成I2 | |
| C. | 可以用CCl4直接将海带中的碘元素萃取出来 | |
| D. | 将海带灼烧的目的是除掉其中的有机物,将碘元素转化为I- |
分析 从海带中提取碘的实验步骤为: ,据此分析.
,据此分析.
解答 解:A、从实验步骤可以看出,实验中无升华的步骤,故A错误;
B、将I-全部氧化成I2用的是双氧水,其中用硫酸提供酸性环境,而不能用氯水,会引入杂质,故B错误;
C、必须先将碘离子氧化为碘单质,然后用四氯化碳萃取,而不能用四氯化碳直接将碘离子萃取,故C错误;
D、海带的主要成分是纤维素等有机物,故灼烧可以除去这些有机物,从而获得碘离子,故D正确.
故选D.
点评 本题考查了海带中碘的提取,应注意实验步骤和原理,综合性较强,难度适中.

练习册系列答案
相关题目
18.在块状锌与0.5mol/LH2SO4溶液的反应中,下列实验操作不能加快氢气产生速率的是( )
| A. | 将H2SO4溶液改为浓硫酸 | |
| B. | 用1mol/LH2SO4溶液代替原H2SO4溶液 | |
| C. | 用锌粉代替块状锌 | |
| D. | 用同浓度热的H2SO4溶液代替原H2SO4溶液 |
19.有关NaHCO3和Na2CO3的性质,以下叙述错误的是( )
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀 | |
| D. | 同物质的量浓度的两种溶液,Na2CO3溶液的碱性强于NaHCO3溶液 |
16.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
| A. | 同周期元素中X的金属性最强 | B. | 原子半径X>Y,离子半径X+>Z2- | ||
| C. | 同族元素中Z的氢化物稳定性最高 | D. | 同周期元素中Y氢化物最稳定 |
3.下列装置中的纯锌棒都浸在相同浓度的稀硫酸中,锌棒腐蚀速度从快到慢的顺序是( )

| A. | ③④②① | B. | ②③①④ | C. | ④②①③ | D. | ③②①④ |
20.一定条件下,分子式为C5H12O且最终能被氧化成羧酸的物质有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17. 有机物A和B是正处于临床试验阶段的小分子抗癌药物,结构如下:关于有机物A和B的叙述,正确的是( )
有机物A和B是正处于临床试验阶段的小分子抗癌药物,结构如下:关于有机物A和B的叙述,正确的是( )
 有机物A和B是正处于临床试验阶段的小分子抗癌药物,结构如下:关于有机物A和B的叙述,正确的是( )
有机物A和B是正处于临床试验阶段的小分子抗癌药物,结构如下:关于有机物A和B的叙述,正确的是( )| A. | 二者都能与Br2发生反应,等物质的量A和B最多消耗的Br2的比例为2:3 | |
| B. | 都属于芳香族化合物,都能和NaHCO3溶液反应 | |
| C. | 两种分子中都有一个手性碳原子 | |
| D. | 等物质的量A和B最多消耗的氢氧化钠质量比为1:1 |
18.能把K2CO3、NH4C1、NaC1、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热)( )
| A. | Ba(OH)2 | B. | NaOH | C. | BaCl2 | D. | AgNO3 |
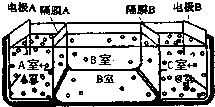 海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.