题目内容
13. 海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.(1)常用的海水淡化方法有蒸馏法、膜法(电渗析、反渗透)、冷冻法、离子交换法等.
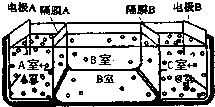
(2)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是阴离子交换膜(填:阴离子交换膜或阳离子交换膜)
②从宁波港采集的海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-若用上述装置对采自宁波港的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为pHa<pHb<pHc
③请写出用电渗析法对采自宁波港的海水进行淡化处理时所发生的化学反应方程式2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(3)具有暂时硬度的硬水在长时间加热煮沸后,生成沉淀的主要成分是CaCO3、Mg(OH)2.
(4)为获得纯净水(去离子水),某同学在实验室将含Mg2+、Ca2+、Cl-的硬水先后通过阴离子交换树脂[如RN(CH3)3OH]和阳离子交换树脂[如RSO3H],写出Cl-与上述离子交换反应的方程式RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-;结果实验未获得成功,其可能原因是阴离子交换树脂交换出的OH-和Mg2+、Ca2+等反应生成沉淀堵塞了离子交换柱.
分析 (1)海水淡化即利用海水脱盐生产淡水的过程,常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等;
(2)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电;根据电极反应来书写总的电解反应;
(3)水垢的主要成分是氢氧化镁和碳酸钙;
(4)阴离子交换树脂可以实现阴离子之间的交换,碱性环境下,镁离子易形成沉淀物.
解答 解:(1)海水淡化常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等,
故答案为:蒸馏;膜;
(2)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,
故答案为:阴离子交换膜;
②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,
故答案为:pHa<pHb<pHc;
③电解氯化钠的反应原理为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)水垢的主要成分是氢氧化镁和碳酸钙,也是具有暂时硬度的硬水在长时间加热煮沸后生成沉淀的主要成分,
故答案为:CaCO3、Mg(OH)2;
(4)阴离子交换树脂可以实现阴离子之间的交换,所以Cl-与阴离子交换树脂反应的方程式为:RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-,碱性环境下,镁离子易形成沉淀物,会堵塞了离子交换柱,所以离子交换树脂有时不起作用,
故答案为:RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-,阴离子交换树脂交换出的OH-和Mg2+、Ca2+等反应生成沉淀堵塞了离子交换柱.
点评 本题是一道化学和技术的题目,题目难度较大,考查学生分析和解决问题的能力,题干信息的分析判断是解题关键.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由于石墨转化为金刚石是吸热反应,所以金刚石比石墨稳定 | |
| C. | 在稀溶液中,强酸与强碱反应生成1molH2O将吸收57.3kJ热量 | |
| D. | 在101kPa时,2g氢气完全燃烧生成液态水放出285.8kJ热量,则等质量的氢气完全燃烧生成气态水时放出热量将小于285.8kJ |
| A. | 混合气通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气通过盛水的洗气瓶 | |
| C. | 混合气通过盛足量溴水的洗气瓶 | |
| D. | 混合气跟氯化氢混合 |
| A. | 硝酸铵 | B. | 浓硫酸 | C. | 食盐 | D. | 生石灰 |
| A. | 实验中包含溶解、过滤、升华等步骤 | |
| B. | 加入过量的氯水将I-全部氧化成I2 | |
| C. | 可以用CCl4直接将海带中的碘元素萃取出来 | |
| D. | 将海带灼烧的目的是除掉其中的有机物,将碘元素转化为I- |
| A. | 人体内没有水解纤维素的酶,所以纤维素在人体内没有任何作用 | |
| B. | 变质的油脂有难闻的哈喇味是因为油脂发生了加成反应 | |
| C. | 吃馒头时越嚼越感觉甜是因为淀粉发生了水解反应 | |
| D. | 牛奶中含有丰富的蛋白质,所以羊毛衫上沾有奶渍时可以用加酶洗衣粉洗涤 |
| A. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| B. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| C. | 通过煤的直接或间接液化,可以获得燃料油及多种化工原料 | |
| D. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 |
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,所以一定要加热反应才能进行 | |
| C. | 断裂反应物中的化学键吸收的能量小于形成生成物中的化学键放出的能量 | |
| D. | 反应物X和Y的总能量一定小于生成物M和N的总能量 |
