题目内容
16.下列说法不符合递变规律的是( )| A. | F2、Cl2、Br2、I2和H2反应激烈程度递减 | |
| B. | HF、HCl、HBr、HI热稳定性减小 | |
| C. | F2、Cl2、Br2、I2的氧化性递增 | |
| D. | F-、Cl-、Br-、I-失电子能力递增 |
分析 A.非金属性越强,与氢气化合越易;
B.非金属性越大,对应氢化物越稳定;
C.非金属性越强,对应单质的氧化性越强;
D.非金属性越强,对应阴离子的还原性越弱.
解答 解:A.非金属性F>Cl>Br>I,则F2、Cl2、Br2、I2和H2反应激烈程度递减,故A正确;
B.非金属性F>Cl>Br>I,则HF、HCl、HBr、HI热稳定性减小,故B正确;
C.非金属性F>Cl>Br>I,则F2、Cl2、Br2、I2的氧化性递减,故C错误;
D.非金属性F>Cl>Br>I,则F-、Cl-、Br-、I-失电子能力递增,故D正确;
故选C.
点评 本题考查元素的非金属性,为高频考点,把握元素的位置、性质、元素周期律为解答关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某同学为证明氯化钠晶体中存在离子键,设计了以下实验,其中合理的是( )
| A. | 测量氯化钠的熔点 | B. | 测量固体氯化钠的导电性 | ||
| C. | 测量熔融氯化钠的导电性 | D. | 测量氯化钠水溶液的导电性 |
4.在 pH=1 的溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |
11.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,交警检查利用含有经硫酸酸化的CrO3的纸片可以测出汽车司机是否酒后驾车,反应的化学方程式为:2CrO3+3C2H5OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O,此反应的氧化产物是( )
| A. | CH3CHO | B. | CrO3 | C. | Cr2(SO4)3 | D. | C2H5OH |
1.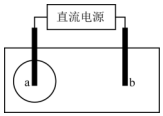 用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )
用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )
 用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )
用两根铅笔芯接触饱和氯化钠溶液浸湿的试纸两端,接通直流电源.很短时间内,a电极与试纸接触处便宜出现一蓝色圆.下列说法正确的是( )| A. | 该试纸可能是pH试纸,b电极为正极 | |
| B. | 该试纸可能是pH试纸,b电极处亦出现一蓝色圆 | |
| C. | 该试纸可能是淀粉碘化钾试纸,b电极附近溶液pH变小 | |
| D. | 该试纸可能是淀粉碘化钾试纸,b电极处发生还原反应 |
8. 在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )
在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )
 在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )
在如图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
5.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH>HCO3-,其中不正确的是( )
| A. | pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+) | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
