题目内容
6.根据下列框图回答问题(答题时方程式中的M、E用所对应的元素符号表示):
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:Cu+H2O2+H2SO4═CuSO4+2H2O.
(2)写出X生成Y的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(3)某同学取Y的溶液,酸化后加入KI淀粉溶液,溶液变为蓝色.写出与上述变化过程相关的离子方程式:2Fe3++2I-=2Fe2++I2.
(4)写出将Cl2通入足量氢氧化钾溶液中反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
分析 由红色金属反应生成蓝色溶液可知M为Cu,蓝色溶液为CuSO4,Y与KSCN混合得到红色溶液,可知Y中含铁离子,则金属E为Fe,Fe与CuSO4反应生成Cu和X,X为FeSO4,X中亚铁离子被氯气氧化生成Fe3+,Y与KOH反应生成Z为Fe(OH)3,结合物质的性质及化学用语来解答.
解答 解:(1)M为Cu,溶于稀H2SO4和H2O2混合液的化学方程式为Cu+H2O2+H2SO4═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4═CuSO4+2H2O;
(2)X为FeSO4,X生成Y的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)Y的溶液含Fe3+,酸化后加入KI淀粉溶液,溶液变为蓝色,可知离子反应为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)Cl2通入足量氢氧化钾溶液中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、相互转化为解答关键,侧重分析与推断能力的考查,红色金属、红色溶液为推断的突破口,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
16.下列说法不符合递变规律的是( )
| A. | F2、Cl2、Br2、I2和H2反应激烈程度递减 | |
| B. | HF、HCl、HBr、HI热稳定性减小 | |
| C. | F2、Cl2、Br2、I2的氧化性递增 | |
| D. | F-、Cl-、Br-、I-失电子能力递增 |
14.下列离子能大量共存的是( )
| A. | 含有大量Ba(NO3 )2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 在碱性溶液中:Na+、K+、SO42-、CO32- | |
| D. | 在酸性的溶液中:Na+、K+、CO32-、NO3- |
11.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
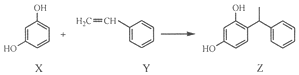
下列叙述错误的是( )

下列叙述错误的是( )
| A. | X和Z均能与FeCl3溶液反应显紫色 | |
| B. | X和Z均能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |
18.表中对于相关物质的分类全部正确的一组是( )
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 纯碱 | 浓硫酸 | CaO | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | Na2O2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
15.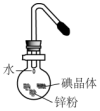 将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )
将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )
 将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )
将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )| A. | Zn与I2的反应是放热反应 | B. | 水在该反应中作催化剂 | ||
| C. | 生成的碘化锌为紫红色 | D. | 紫红色的蒸气是碘升华所致 |
16.300mL某浓度的NaOH溶液中含有60g溶质.现欲配制80mL 1mol/LNaOH溶液,应取该溶液的体积为( )
| A. | 16mL | B. | 20mL | C. | 32mL | D. | 40mL |
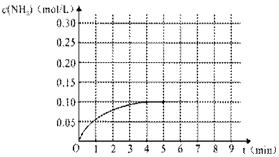 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图: