题目内容
2.(1)实验室配置的浓Na2S溶液有臭鸡蛋气味,原因是S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-(写出相关的离子方程式)(2)向含Cu2+的废水中加入FeS固体,除去Cu2+的离子方程式:Cu2+(ag)+FeS=Fe2+(ag)+CuS;
(3)用CO气体还原1molFe2O3固体,放热24.8kJ,该反应的热化学方程式:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol;
(4)氯碱工业中电解饱和食盐水反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑其中阴极产物为H2,验证阳极产物的方法是湿润的淀粉KI试纸若原料NaCl溶液中含有杂质CaCl2,则除杂所用的方法为加入碳酸钠.
分析 (1)Na2S为强碱弱酸盐,易水解;
(2)CuS的溶解度比FeS小,从沉淀的转化的角度分析;
(3)用CO气体还原1molFe2O3固体,放热24.8kJ,结合方程式书写热化学方程式,注意物质的聚集状态;
(4)电解饱和氯化钠溶液,阳极发生氧化反应,生成氯气,阴极生成氢气,可加入碳酸钠除去氯化钠中的氯化钙杂质.
解答 解:(1)Na2S为强碱弱酸盐,易水解,有臭鸡蛋气味,说明生成硫化氢,离子方程式为S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-,故答案为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
(2)CuS的溶解度比FeS小,可实现沉淀的转化,方程式为Cu2+(ag)+FeS=Fe2+(ag)+CuS,故答案为:Cu2+(ag)+FeS=Fe2+(ag)+CuS;
(3)用CO气体还原1molFe2O3固体,放热24.8kJ,反应的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
故答案为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol;
(4)电解饱和氯化钠溶液,阳极发生氧化反应,生成氯气,可用湿润的淀粉KI试纸检验,阴极生成氢气,电解方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,可加入碳酸钠除去氯化钠中的氯化钙杂质,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;H2;湿润的淀粉KI试纸;加入碳酸钠.
点评 本题考查较为综合,涉及盐类的水解、难溶电解质的溶解平衡、热化学方程式以及电解等知识,为高频考点,侧重考查学生的分析能力,注意相关知识的积累,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol•L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol•L-1 | 0.010 | 0.010 | 0.020 |
| A. | 平衡时,乙中CO2的转化率大于60% | |
| B. | 平衡时,甲中和丙中H2的转化率均是60% | |
| C. | 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol•L-1 | |
| D. | 反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1mol H2O在标准状况下的体积为22.4 L | |
| D. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA |
| A. | KOH和AlCl3 | B. | 稀盐酸和NaOH | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
| A. | 用镊子从试剂瓶中夹取钠块 | |
| B. | 用水清洗试管内壁附着的硫 | |
| C. | 采用“扇闻”的方法闻氯气的气味 | |
| D. | 用洁净的铂丝蘸取溶液进行焰色反应的实验 |
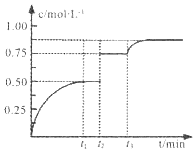 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质C | |
| D. | t1~t3间该反应的平衡常数均为4 |
| A. | 0.1 mol•L-1 NH4HS溶液中有:c(NH4+)<c(HS-)+c(S2-)+c(H2S) | |
| B. | 在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①>③>② |
| A. | F2、Cl2、Br2、I2和H2反应激烈程度递减 | |
| B. | HF、HCl、HBr、HI热稳定性减小 | |
| C. | F2、Cl2、Br2、I2的氧化性递增 | |
| D. | F-、Cl-、Br-、I-失电子能力递增 |