题目内容
下面的排序不正确的是( )
| A、金属Cu中Cu原子堆积方式为面心立方最密堆积,每个Cu原子的配位数均为12 |
| B、晶体的熔点:SiC>CCl4>P4>SO2 |
| C、酸性:HClO4>HClO3>HClO |
| D、晶格能由大到小:NaF>NaCl>NaBr>NaI |
考点:用晶格能的大小衡量离子晶体中离子键的强弱,晶体的类型与物质熔点、硬度、导电性等的关系,金属晶体的基本堆积模型
专题:
分析:A.在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连;
B.一般来说晶体的熔点:原子晶体>离子晶体>分子晶体;
C.同一种元素的含氧酸,非羟基氧越多,酸性越强;
D.离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强.
B.一般来说晶体的熔点:原子晶体>离子晶体>分子晶体;
C.同一种元素的含氧酸,非羟基氧越多,酸性越强;
D.离子晶体中离子键越强晶格能越大,电荷越多、离子半径越小,离子键越强.
解答:
解:A.在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,故A正确;
B.一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,碳化硅为原子晶体,故熔点最高,白磷常温下为固体,四氯化碳为液体,二氧化硫为气体,则晶体的熔点SiC>P4>CCl4>SO2,故B错误;
C.同一种元素的含氧酸,非羟基氧越多,酸性越强;HClO4、HClO3、HClO非羟基氧分别为3、2、0故酸性顺序为:HClO4>HClO3>HClO,故C正确;
D、离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选B.
B.一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,碳化硅为原子晶体,故熔点最高,白磷常温下为固体,四氯化碳为液体,二氧化硫为气体,则晶体的熔点SiC>P4>CCl4>SO2,故B错误;
C.同一种元素的含氧酸,非羟基氧越多,酸性越强;HClO4、HClO3、HClO非羟基氧分别为3、2、0故酸性顺序为:HClO4>HClO3>HClO,故C正确;
D、离子半径F-<Cl-<Br-<I-,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选B.
点评:本题考查金属晶体的堆积模型、晶体类型与熔点、含氧酸的酸性、晶格能大小,难度中等,注意非羟基氧和含氧酸酸性的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,22.4 L O2含有的分子数目为NA |
| B、1 mol Cl2作为氧化剂得到的电子数为NA |
| C、常温常压下,16 g 氧气含有的氧原子数目为 NA |
| D、0.5 mol/LNa2CO3溶液中,Na+的数目为NA |
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为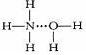 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |
某合金(仅含铜铁)中铜后和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50mlbmol?L-1的硝酸溶液中,加热时期充分反应(假设NO是唯一的还原产物),下列说法正确的是( )
| A、若金属剩余,向溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中一含有Fe3+ |
| C、若金属全部溶解,且产生336ml气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a和b的关系没法确定 |
现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离其中试剂1、2、4分别为( )
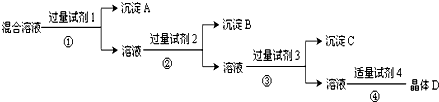

| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |